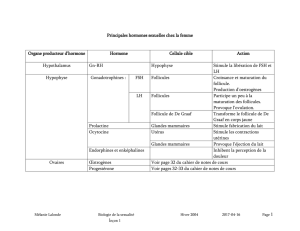
E´tat actuel de la folliculogene`se in vitro chez la souris State of the

Faits et arguments
E
´tat actuel de la folliculogene
`se in vitro chez la souris
State of the art on in vitro folliculogenesis in mouse
C. Mazoyer
a,b,c
, B. Courbie
`re
a,c
, B. Salle
c
, J. Smitz
b
, J. Lornage
a,c,
*
a
Unite
´Inserm 418, ho
ˆpital Debrousse, 29, rue Soeur-Bouvier, 69322 Lyon cedex 05, France
b
Universitair Ziekenhuis Vrije Universiteit Brussel (UZ VUB), Laarbeeklaan, 101, 1090 Jette, Belgique
c
Laboratoire de biologie de la reproduction et Cecos de Lyon, ho
ˆpital E
´douard-Herriot, 8, avenue Rockefeller, 69373 Lyon cedex 08, France
Rec¸u le 18 fe
´vrier 2007 ; accepte
´le 9 juillet 2007
Re
´sume
´
Les syste
`mes de culture folliculaire ont e
´te
´de
´veloppe
´s dans le but de permettre la fe
´condation in vitro d’ovocytes issus de follicules pre
´leve
´s
immatures. Les techniques de folliculogene
`se in vitro pourraient en particulier e
ˆtre applique
´es en me
´decine de la reproduction, pour restaurer la
fertilite
´des patientes ayant be
´ne
´ficie
´d’une cryoconservation ovarienne. Plusieurs syste
`mes de culture, permettant la croissance in vitro de
follicules de stades de de
´veloppement pre
´coces, ont e
´te
´mis au point chez la souris et valide
´s par des naissances de souriceaux viables. Certaines
caracte
´ristiques des syste
`mes de culture se sont re
´ve
´le
´es essentielles pour la re
´ussite de la folliculogene
`se in vitro : isolement des follicules a
`un
stade de
´termine
´, maintien de la morphologie folliculaire et apport de facteurs de croissances ou d’hormones. Ces me
´thodes de culture folliculaire
ont permis une meilleure compre
´hension de la physiologie ovarienne, celle, notamment de la relation entre les facteurs endocrines ou paracrines et
le de
´veloppement du follicule. La technique de croissance folliculaire in vitro chez la souris est devenue un ve
´ritable outil biologique pour
l’ame
´lioration des techniques en reproduction comme pour les e
´tudes toxicologiques.
#2007 Elsevier Masson SAS. Tous droits re
´serve
´s.
Abstract
Follicle culture systems have been developed so as to achieve in vitro fertilization of oocytes coming from immature follicles. The in vitro
folliculogenesis methods would be especially useful in reproductive medecine to restore fertility in women having undergone ovarian cryopreserva-
tion. Several culture systems allowing invitro growth of small follicles have been developed in mouse. These have proven to be sucessful by the birth of
healthy offsprings. Some elements determine the outcome of culture: follicle isolations at a defined stage of development, follicular morphology
preservation, and supplementation of growth factors or hormones. Development of follicle culture in the mouse model led to a better understanding of
ovarian physiology, in particular the relation between endocrine and paracrine factors on follicle development. The in vitro techniques in mouse
became a valuable tool for improving reproductive technics improvement, and for toxicology studies.
#2007 Elsevier Masson SAS. Tous droits re
´serve
´s.
Mots cle
´s: Me
´decine de la reproduction ; Folliculogene
`se ; Maturation in vitro ; Ovaire ; Culture folliculaire ; De
´veloppement folliculaire ; Ovocyte ; Mode
`le
souris ; Facteurs de croissance
Keywords: Reproductive medicine; Folliculogenesis; In vitro maturation; Ovary; Follicular culture; Follicular development; Oocyte; Mouse model; Growth factors
1. Introduction
Les me
´canismes du de
´veloppement folliculaire et de la
re
´gulation de la folliculogene
`se dans l’ovaire sont complexes et
en partie me
´connus. L’e
´tude de la physiologie ovarienne et
notamment celle des follicules est indispensable pour
l’ame
´lioration des techniques en me
´decine de la reproduction.
La culture de follicules in vitro est une alternative aux e
´tudes in
vivo pour approfondir les connaissances sur la folliculogene
`se
car elle permet d’e
´tudier plus pre
´cise
´ment ses me
´canismes [1].
Le de
´veloppement de syste
`mes de culture folliculaire
trouverait une application en biologie de la reproduction en
http://france.elsevier.com/direct/GYOBFE/
Disponible en ligne sur www.sciencedirect.com
Gyne
´cologie Obste
´trique & Fertilite
´36 (2008) 6–16
* Auteur correspondant.
Adresse e-mail : [email protected] (J. Lornage).
1297-9589/$ – see front matter #2007 Elsevier Masson SAS. Tous droits re
´serve
´s.
doi:10.1016/j.gyobfe.2007.07.042

se substituant aux lourds traitements de stimulation ovarienne.
La culture folliculaire repre
´senterait e
´galement une option pour
restaurer la fertilite
´des femmes ou des jeunes filles ayant
be
´ne
´ficie
´d’une cryoconservation ovarienne avant un traitement
anticance
´reux. En effet, ces traitements sont gonadotoxiques et
ces femmes risquent d’e
ˆtre infertiles, notamment a
`la suite
d’une insuffisance ovarienne pre
´coce. Le but de cette technique
est de pre
´server des fragments de cortex ovarien pour une
utilisation future qui permettrait la reprise du de
´veloppement
folliculaire, telles la greffe ou la culture folliculaire. Dans le cas
de la folliculogene
`se in vitro, le but serait de cultiver des
follicules immatures jusqu’au stade pre
´ovulatoire, puis de
re
´aliser une fe
´condation in vitro. De plus, pour certains cancers,
des cellules cance
´reuses peuvent e
ˆtre pre
´sentes dans le
fragment ovarien. Le de
´veloppement in vitro des follicules
immatures issus d’ovaires de patientes ayant surve
´cu a
`un
cancer pourrait e
´viter tout risque de transmission.
Chez l’ensemble des mammife
`res, la folliculogene
`se
posse
`de certaines caracte
´ristiques semblables. La souris a
souvent e
´te
´choisie comme mode
`le d’e
´tude pour en explorer les
me
´canismes. Ce choix pre
´sente plusieurs avantages. La dure
´e
ne
´cessaire au de
´veloppement du follicule jusqu’a
`l’ovulation
est d’environ trois semaines, ce qui permet de re
´aliser les e
´tudes
de la folliculogene
`se dans un laps de temps raisonnable. In
vitro, la souris est le seul animal chez lequel des naissances de
jeunes viables ont e
´te
´obtenues gra
ˆce au de
´veloppement de
follicules a
`partir de stades pre
´coces [2–5].
Les diffe
´rents syste
`mes de culture mis au point ont permis
l’e
´tude de l’influence de plusieurs parame
`tres sur le de
´velop-
pement folliculaire in vitro, comme l’apport de gonadotro-
phines [6] ou celui d’oxyge
`ne [7]. Les travaux re
´alise
´s in vitro
ont e
´galement apporte
´des pre
´cisions sur la re
´gulation de la
folliculogene
`se, notamment sur les facteurs modulant l’initia-
tion de croissance tel que l’anti-mullerian hormone (AMH) [8].
A
`ce jour, plusieurs me
´thodes de culture de follicules ovariens a
`
des stades pre
´coces ont e
´te
´de
´veloppe
´es. Les travaux d’Eppig et
O’Brien ont permis l’ache
`vement d’une folliculogene
`se in vitro
comple
`te a
`partir de follicules primordiaux [3,5]. D’autres
travaux ont permis la naissance des souriceaux a
`partir de
follicules isole
´s aux stades primaires ou pre
´antraux [2,4,9].
L’ensemble des e
´tudes ayant explore
´la folliculogene
`se in vitro
a permis de connaı
ˆtre les conditions de culture critiques pour la
croissance, la survie, la maturation des follicules et la qualite
´
ovocytaire.
2. A
`partir de quel stade folliculaire la folliculogene
`se in
vitro est-elle possible ?
Le mode
`le souris est un mode
`le avantageux pour
l’exploration du de
´veloppement du follicule in vitro. La
formation des follicules a lieu a
`la naissance et le
de
´veloppement de l’ensemble des follicules inclus dans la
premie
`re vague de croissance se fait de fac¸on synchronise
´e. Est
ainsi rendue possible l’obtention d’une population homoge
`ne
de follicules et donc la mise au point de diffe
´rentes me
´thodes de
cultures in vitro a
`partir de follicules de taille similaire. En effet,
l’a
ˆge des jeunes souris utilise
´es peut e
ˆtre se
´lectionne
´en
fonction du stade de de
´veloppement folliculaire maximum
de
´sire
´[10]. Le mate
´riel de de
´part e
´tait constitue
´soit d’ovaires
de souris nouveau-ne
´es entiers dans lesquels on ne trouve que
des follicules primordiaux [3,5], soit d’ovaires de souris
pre
´pube
`res pour isoler des follicules aux stades primaire [11] ou
pre
´antral [4,12].
2.1. Culture d’ovaire entier suivie de culture des
complexes ovocytes–cellules de la granulosa (COGC)
Dans les travaux d’Eppig et O’Brien, des ovaires ont e
´te
´
pre
´leve
´s sur des souris nouveau-ne
´es le jour de leur naissance
[3,5]. Les ovaires ne contenaient alors que des follicules
primordiaux. Les ovaires ont e
´te
´cultive
´s entiers, par groupe,
pendant huit jours, sur une membrane poreuse de polycarbonate
flottant sur le milieu de culture. Cette e
´tape a permis l’initiation
de la croissance des follicules primordiaux et le passage aux
stades follicules primaires ou secondaires (Fig. 1 [5]). De
manie
`re similaire aux premie
`res entre
´es en croissance in vivo,
l’initiation de la croissance in vitro a e
´te
´observe
´e de fac¸on
pre
´ponde
´rante dans la re
´gion me
´dullaire [5]. Dans ces travaux,
les ovocytes contenus dans les ovaires cultive
´s pendant huit
jours ont atteint un diame
`tre comparable a
`celui des follicules
Fig. 1. Ovaire de souris a
ˆge
´e de huit jours (a) et ovaire de souris nouveau-ne
´e apre
`s culture de huit jours (b), d’apre
`s Eppig et O’Brien [5]. Les follicules en croissance
sont situe
´s dans la zone me
´dullaire (fle
`ches blanches) alors que les follicules primordiaux restants se trouvent dans la re
´gion corticale (fle
`ches noires). Les follicules en
croissance pre
´sentent un ovocyte plus gros et sont entoure
´s d’une ou deux couches de cellules de la granulosa. La membrane basale entourant les follicules n’est
pre
´sente que partiellement dans le tissu cultive
´.
C. Mazoyer et al. / Gyne
´cologie Obste
´trique & Fertilite
´36 (2008) 6–16 7

de
´veloppe
´s in vivo en huit jours (48 versus 44 mm) [5].
Cependant, la membrane basale e
´tait parfois incomple
`te et la
couche de cellules the
´cales apparaissait moins de
´finie que dans
les ovaires de souris de huit jours. La seconde e
´tape a consiste
´a
`
isoler, gra
ˆce a
`l’action de la collage
´nase, les COGC du tissu
ovarien. Ces complexes e
´taient forme
´s d’un ovocyte entoure
´
d’une ou deux couches cellulaires, la membrane basale e
´tant en
partie de
´grade
´e par le traitement enzymatique (Fig. 2a[5]). Les
complexes ont e
´te
´cultive
´s sur des membranes poreuses traite
´es
au collage
`ne pendant 14 jours supple
´mentaires (Fig. 2b[5]).
Apre
`s la maturation ovocytaire en pre
´sence de la follicle
stimulating hormone (FSH), les ovocytes ont e
´te
´de
´nude
´s des
cellules de la granulosa et mis en fe
´condation. En 2003, l’e
´quipe
d’O’Brien et al. [3] are
´vise
´son protocole de culture en modifiant
plusieurs parame
`tres concernant la composition du milieu. Ces
modifications ont permis d’ame
´liorer la maturation ovocytaire et
le de
´veloppement embryonnaire. Cette e
´tude a montre
´que les
conditions de culture e
´taient optimales pour le de
´veloppement
pre
´implantatoire lorsque la FSH e
´tait supprime
´e en fin de culture
afin d’e
´liminer les effets de
´le
´te
`res sur l’embryon de la FSH
associe
´ea
`l’insuline [13]. Dans ce me
ˆme but, le milieu aMEM a
e
´te
´pre
´fe
´re
´au milieu Waymouth pour les six derniers jours de
culture, car il posse
`de une plus faible concentration de glucose.
L’acide ascorbique, pre
´sent en quantite
´plus importante dans le
aMEM, favorisait le de
´veloppement in vitro des COGC [13].
Enfin, dans le protocole re
´vise
´,delafe
´tuine a e
´te
´ajoute
´e dans le
milieu sur l’ensemble de la culture des COGC pour e
´viter le
durcissement de la zone pellucide. Sur 190 embryons transfe
´re
´s
dans le protocole original, seul un souriceau viable est ne
´(0,5 %)
[5]. Le protocole re
´vise
´utilise
´en 2003 a permis une ame
´lioration
significative de la maturation ovocytaire avec une augmentation
du nombre de naissances obtenues : 66 souriceaux, soit 6 % des
embryons transfe
´re
´s[3]. Cependant, les taux restent infe
´rieurs a
`
ceux obtenus avec fe
´condation in vitro d’ovocytes issus d’ovaires
de souris a
ˆge
´es de 22 jours (17 %) [3].
2.2. Culture de follicules isole
´s
D’autres travaux ont e
´te
´re
´alise
´sa
`partir d’un stade
folliculaire plus tardif. Ils concernent tous des cultures de
follicules isole
´s[4,9,11,12]. La culture de follicules isole
´sn’a
pu e
ˆtre re
´alise
´e qu’a
`partir de follicules de diame
`tre supe
´rieur a
`
80 mm, correspondant au stade grand follicule primaire. Les
follicules ont e
´te
´isole
´s, soit me
´caniquement a
`l’aide de fines
aiguilles, soit enzymatiquement par l’utilisation de collage
´-
nase. La se
´lection d’une population homoge
`ne de follicules
peut e
ˆtre re
´alise
´e sous le grossissement 400 du microscope en
mesurant le diame
`tre du follicule et en de
´nombrant le nombre
de couches cellulaires qui entourent l’ovocyte. Lorsque les
souris e
´taient a
ˆge
´es de huit a
`14 jours, les follicules obtenus
pre
´sentaient une a
`deux couches de cellules [9,11,12].Chezdes
souris plus a
ˆge
´es, les ovaires contenaient des follicules
pre
´antraux plus tardifs, mesurant de 150 a
`200 mm[4,14].
Les follicules ont e
´te
´cultive
´sdansdesconditionstre
`s variables
de support et de milieux en culture. La rupture du follicule
mimant l’ovulation du follicule et la maturation de l’ovocyte in
vitro ont e
´te
´obtenues de deux fac¸ons. Dans certains travaux,
les follicules ont e
´te
´incube
´s avec la luteinizing hormone (LH)
[4] ou avec une association d’human chorionic gonadotropin
(HCG) et de l’epidermal growth factor (EGF) [12,15],puisles
ovocytes ont e
´te
´de
´nude
´sme
´caniquement. L’ovulation a e
´te
´
e
´galement mime
´eme
´caniquement in vitro en ponctionnant les
complexes ovocyte–cellules de la granulosa et en plac¸ant
ensuite les ovocytes quelques heures dans un milieu de
maturation.
Les me
´thodes de validation des syste
`mes de culture e
´taient
varie
´es : survie folliculaire, appre
´ciation de la morphologie,
e
´valuation de la ste
´roı
¨dogene
`se in vitro, maturation de
l’ovocyte, compe
´tence a
`la fe
´condation ou encore naissance
de souriceaux viables. Seul un petit nombre d’e
´quipes a publie
´
des naissances (Tableau 1) conse
´cutives a
`une culture de
follicules isole
´sa
`un stade pre
´coce [2,4,9], avec un rapport
naissances/embryons transfe
´re
´s variant entre 5 et 6 %.
L’obtention de naissances est un objectif difficile a
`atteindre,
complique
´par la technique de transfert embryonnaire. Plus
simplement, le diame
`tre final de l’ovocyte, associe
´a
`sa
compe
´tence a
`former le premier globule polaire, pourrait
fournir un bon indice de la re
´ussite de la culture.
Ces syste
`mes de culture ont e
´galement permis d’e
´tudier les
interactions interfolliculaires en re
´alisant des cocultures de
Fig. 2. Complexes ovocytes–cellules de la granulosa, d’apre
`s Eppig et O’Brien [5]. Les complexes isole
´sa
`partir des ovaires entiers cultive
´s (a) ; (b) ces me
ˆmes
complexes apre
`s 14 jours de culture : les cellules de la granulosa ont prolife
´re
´autour de l’ovocyte (fle
`ches) ; e
´chelle 50 mm (a) et 100 mm (b).
C. Mazoyer et al. / Gyne
´cologie Obste
´trique & Fertilite
´36 (2008) 6–168

follicules de stades diffe
´rents [14,16,17]. Ces mode
`les ont
permis de mimer in vitro le phe
´nome
`ne de dominance, mettant
en e
´vidence la se
´cre
´tion par le follicule antral de facteurs
inhibant la croissance du follicule pre
´antral cocultive
´lors de la
diminution de l’apport de la FSH.
3. Parame
`tres influenc¸ant le de
´veloppement des
follicules
Diverses me
´thodes de culture in vitro ont e
´te
´de
´veloppe
´es
[4,5,7,9,11,14]. La variabilite
´des syste
`mes e
´tudie
´s a permis de
mettre en e
´vidence l’influence directe ou indirecte des supports,
hormones, facteurs de croissance et gaz utilise
´s sur le
de
´veloppement folliculaire in vitro.
3.1. Syste
`mes de culture et structure tridimensionnelle du
follicule
3.1.1. Isolement des follicules
Tous les protocoles de culture ont eu une e
´tape commune :
l’isolement des follicules pre
´antraux. Les follicules ont e
´te
´
isole
´s, soit me
´caniquement a
`l’aide de fines aiguilles [9,11,12],
soit enzymatiquement par l’utilisation d’enzymes prote
´olyti-
ques comme la collage
´nase [3,9]. En comparant les deux types
d’isolement, Demeestere et al. ont montre
´que la me
´thode
enzymatique pre
´sentait l’avantage de collecter un nombre
important de follicules [18]. Cependant, avec la me
´thode
enzymatique, l’inte
´grite
´structurale des follicules n’a pas e
´te
´
pre
´serve
´e : les complexes ovocytes–granulosa obtenus e
´taient
compose
´s d’ovocytes entoure
´s de manie
`re irre
´gulie
`re de
quelques couches de cellules somatiques. La membrane basale
ae
´te
´alte
´re
´e et les cellules the
´cales semblaient e
ˆtre e
´limine
´es.
Au contraire, la me
´thode me
´canique a permis d’obtenir des
follicules pre
´antraux intacts avec un ovocyte central, entoure
´
des cellules de la granulosa, de la membrane basale et de
quelques cellules the
´cales. Cette technique a e
´galement montre
´
un meilleur taux de survie en fin de culture. De fac¸on identique
a
`la situation in vivo, la membrane basale joue un ro
ˆle essentiel
dans le maintien de la structure sphe
´rique du follicule in
vitro, ce qui e
´vite la libe
´ration de l’ovocyte avant la fin de la
culture et donc une meilleure survie des follicules. La taille des
ovocytes en fin de culture e
´tait de 67 mm et le taux de
maturation variait autour de 70 % quelle que soit la technique
choisie [18].
3.1.2. Supports de culture
Certains supports ont permis de pre
´server la structure
sphe
´rique du follicule, comme la culture en gel de collage
`ne
type I et III [19], d’alginate [20] ou d’agar [21] qui stabilise la
structure tridimensionnelle. La culture en puits de plaque de
microtitration, associe
´ea
`un transfert des follicules dans de
nouveaux puits tous les deux jours [4], a permis e
´galement une
croissance de follicules morphologiquement similaires aux
follicules de
´veloppe
´s in vivo, c’est-a
`-dire conservant une
couche de cellules the
´cales entourant la membrane basale. De
me
ˆme, le de
´veloppement in vitro de follicules sur des
membranes poreuses non adhe
´rentes a e
´vite
´l’adhe
´sion des
cellules et a pre
´serve
´la structure tridimensionnelle du follicule
[14]. La structure folliculaire a e
´te
´e
´galement peu modifie
´e
lorsque les follicules ont e
´te
´de
´pose
´s sur une membrane poreuse
traite
´e au collage
`ne, car ce traitement a assure
´l’adhe
´rence des
follicules, mais avec une migration minime des cellules de la
granulosa [9].
D’autres supports ont entraı
ˆne
´une modification de la
structure folliculaire, comme la culture en microgoutte de
milieu recouverte d’huile mine
´rale [12]. La structure originale
du follicule s’e
´tait rapidement modifie
´e, conse
´cutive a
`
l’adhe
´sion des cellules the
´cales au support et de la prolife
´ration
et de la migration des cellules de la granulosa en dehors de la
membrane basale. Cependant, le follicule s’e
´tait re
´organise
´
pour former une structure particulie
`re induite par la diffe
´ren-
ciation des cellules de la granulosa, au-dessus d’un tapis de
cellules the
´cales [22]. Les auteurs ont de
´crit que les follicules se
sont re
´organise
´s, soit en do
ˆme pre
´sentant au sommet l’ovocyte
et en dessous une cavite
´type antrum (Fig. 3 [23]), soit en une
structure en forme disque ou
`les cellules de la granulosa
diffe
´rencie
´es ont forme
´un cumulus central entoure
´d’un anneau
de cellules murales. Dans chacun des cas, les interactions entre
les trois types de cellules somatiques rencontre
´s in vivo ont e
´te
´
conserve
´es.
Un syste
`me interme
´diaire biphasique a e
´te
´de
´veloppe
´par
Lenie et al. permettant la culture de follicule a
`partir du stade
primaire [11]. Dans une premie
`re phase, tant que le follicule
n’avait pas atteint 100 mm de diame
`tre, la structure tridimen-
sionnelle du follicule a e
´te
´pre
´serve
´e en empe
ˆchant me
´cani-
quement l’adhe
´sion des cellules the
´cales au support. Puis,
l’adhe
´sion des cellules the
´cales a e
´te
´possible dans la seconde
phase, entraı
ˆnant la restructuration du follicule. Cette technique
a permis la survie des follicules primaires in vitro en e
´vitant la
libe
´ration pre
´coce de l’ovocyte dans les premiers stades de
croissance.
Les syste
`mes de culture peuvent e
ˆtre choisis en fonction du
but de l’e
´tude [10]. Certains syste
`mes permettent de reproduire
la morphologie normale des follicules in vivo en pre
´servant une
unite
´tridimensionnelle multicouches, ce qui est inte
´ressant
pour e
´tudier la physiologie du follicule. Ce syste
`me dit ferme
´
permet alors d’explorer les relations entre les diffe
´rents types
cellulaires ainsi que l’incidence des modifications morpholo-
giques du follicule. Mais dans ces syste
`mes dits ferme
´s,
l’apport des nutriments, des hormones, des facteurs de
croissance et de l’oxyge
`ne au centre de la structure et donc
a
`l’ovocyte est modifie
´. Contrairement a
`la situation in vivo, les
Tableau 1
Synthe
`se des taux d’ovocytes en me
´taphase II (MII) associe
´s aux naissances
obtenues apre
`s folliculogene
`se in vitro chez la souris
Taille finale
de l’ovocyte
(mm)
Taux
d’ovocytes
en MII (%)
Naissances/
embryons
transfe
´re
´s (%)
Eppig et Schroeder [9] 68 24 5
Spears et al. [4] 6
Cortvrindt et al. [2,6,12,23] 74 41 5
Eppig et O’Brien [5] 70 7 0,5
O’Brien et al. [3] 44 5
C. Mazoyer et al. / Gyne
´cologie Obste
´trique & Fertilite
´36 (2008) 6–16 9

facteurs essentiels a
`la survie, la croissance du follicule et la
maturation ovocytaire doivent franchir une barrie
`re non
vascularise
´e. Lorsque les follicules ont conserve
´leur structure
originale, le taux de rupture du follicule apre
`s induction de
l’ovulation a
`l’HCG e
´tait infe
´rieur a
`60 % [24,25]. L’utilisation
de ce me
ˆme mode
`le a montre
´que les ovocytes ovule
´s in vitro
n’ont pas acquis leur compe
´tence me
´iotique malgre
´une
morphologie folliculaire bien conserve
´e et une rupture
folliculaire spontane
´e[26]. Dans une autre e
´tude, la maturation
des complexes cumulus–ovocytes, en dehors du follicule dont
ils ont e
´te
´extraits me
´caniquement, induisait une meilleure
expansion du cumulus que lorsque la maturation se faisait au
sein du follicule [4]. Dans cette e
´tude, le taux d’ovocytes
fe
´conde
´s, atteignant le stade de deux blastome
`res, e
´tait
e
´galement tre
`s supe
´rieur dans le cas ou
`les complexes avaient
e
´te
´mature
´s hors du follicule (41 versus 9 %). Ces re
´sultats
montrent que la diffusion des e
´le
´ments indispensables pour
obtenir un ovocyte de qualite
´, compe
´tents a
`la maturation
nucle
´aire et au de
´veloppement embryonnaire, est nettement
compromise dans les syste
`mes ferme
´s.
Lorsque l’objectif est d’obtenir des ovocytes mu
ˆrs et
compe
´tents au de
´veloppement embryonnaire, l’accessibilite
´
des nutriments, hormones et gaz a
`l’ensemble du follicule est
essentielle. Ce phe
´nome
`ne serait alors facilite
´dans les syste
`mes
dits ouverts, puisque la restructuration du follicule diminue le
confinement du cumulus et de l’ovocyte.
3.2. De
´lai de formation d’un follicule mu
ˆr
Il est ne
´cessaire d’adapter le temps de culture a
`la taille du
follicule de de
´part pour obtenir le stade de follicule mu
ˆrde
manie
`re optimale. Il existe une fene
ˆtre temporelle pre
´cise
durant laquelle l’induction de la maturation finale de l’ovocyte
in vitro peut e
ˆtre optimise
´e. Cette pe
´riode de
´passe
´e, les
follicules en culture de
´ge
´ne
`rent rapidement [23].
La dure
´e de folliculogene
`se in vivo a
`partir de follicules
primordiaux n’e
´tant pas connue pre
´cise
´ment, il est difficile
d’appre
´cier si la dure
´e de la folliculogene
`se in vitro est
similaire. En revanche, la dure
´ene
´cessaire au de
´veloppement
du follicule primaire en follicule pre
´ovulatoire est de 20 jours in
vivo [27]. Dans le syste
`me de culture d’Eppig et O’Brien, il a
fallu 22 jours pour permettre aux follicules primordiaux
d’atteindre le terme de leur de
´veloppement [3,5], alors qu’il en
a fallu 18 lorsque les follicules ont e
´te
´isole
´s au stade primaire
[11] et 12 lorsqu’ils ont e
´te
´isole
´s au stade secondaire [12]
(Fig. 4). Ces temps de croissance variables, associe
´sa
`des
syste
`mes et environnements physicochimiques tre
`s diffe
´rents,
ont montre
´qu’a
`un stade de de
´part de
´fini correspond un
syste
`me de culture particulier. In vitro, les follicules se
retrouvent prive
´s des facteurs re
´gulateurs, produits par la
me
´dullaire ovarienne ou par les follicules adjacents et les
facteurs autocrines ou paracrines se
´cre
´te
´s en cultures, peuvent
diffuser dans le milieu, ce qui diminuerait leur concentration.
Cette divergence avec les conditions in vivo concernant
l’absence de facteurs re
´gulateurs dans le milieu de culture peut
diminuer le temps de transition entre deux stades et modifier la
dure
´e totale de la folliculogene
`se in vitro.
L’appre
´ciation du diame
`tre folliculaire en fin de culture est
rendue difficile a
`cause de la plus ou moins bonne conservation
de la structure du follicule. Il est donc plus juste de s’inte
´resser
au diame
`tre de l’ovocyte apre
`s son extraction du follicule
mature. Ce diame
`tre, qui varie autour de 70 mm(Tableau 1),
Fig. 3. Structure folliculaire remodele
´e, d’apre
`s Cortvrindt et al. [23] :1
er
jour de culture : aspect morphologique normal (A) ; 2
e
jour : adhe
´sion des cellules the
´cales
au support (B) ; 4
e
jour : colonisation des cellules de la granulosa en dehors de la membrane basale (C) ; 10
e
jour : formation d’un do
ˆme avec, au centre, une cavite
´
antrale borde
´e d’un mur de cellules de la granulosa et, au sommet, l’ovocyte entoure
´de cellules du cumulus (D).
C. Mazoyer et al. / Gyne
´cologie Obste
´trique & Fertilite
´36 (2008) 6–1610
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%