13/02/15 GRANGEON Anastasia CR : BRASSIER Julia

NUTRITION – Métabolisme des protéines et cycles de l’urée, moyens d'étude
13/02/15
GRANGEON Anastasia CR : BRASSIER Julia
Nutrition
Pr Raccah
8 pages
Métabolisme des protéines et cycles de l’urée, moyens d'étude
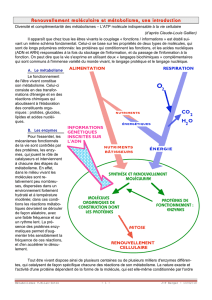
Ce schéma récapitule le plan du cours et contient des chiffres qui ne sont pas détaillés dans la suite du ronéo.
A) Métabolisme des protéines
Il y a un pool de protéines de 11 kg dans l’organisme, son taux est stable.
La synthèse des protéines est complètement contrebalancée par la protéolyse (même quantité de
protéines produites que de protéines détruites), ainsi les pools de protéines et d’aa libres restent assez stables.
1/8
Plan
A) Métabolisme des protéines
I. Utilisation des acides aminés
a) Synthèse protéique
b) Dégradation irréversible des AA
II. Production des acides aminés
a) Protéolyse
b) Apports exogènes
c) Synthèse de Novo endogène des AA non essentiels
B) Moyens d'études du métabolisme des protéines
I. Quantification de la masse protéique totale
II. Bilan azoté dans le cas d'une nutrition artificielle
III. Quantification de la masse musculaire
a) Mesure de l’excrétion urinaire de la créatinine
b) Mesure de l’excrétion urinaire de la 3 méthyl histidine

NUTRITION – Métabolisme des protéines et cycles de l’urée, moyens d'étude
I. Utilisation des acides aminés
a) Synthèse protéique
Pour la synthèse de molécules protéiques, les acides aminés libres circulants pénètrent à l’intérieur de la
cellule par l’intermédiaire de 4 types de transporteurs intracellulaires différents. Ces transporteurs sont
spécifiques de certains acides aminés. Or, il y a 20 acides aminés pour seulement 4 transporteurs, donc 1
transporteur peut permettre le passage de plusieurs AA différents.
Avant d’être utilisés pour la synthèse protéique, ces AA doivent être activés par un ARN de transfert
(ARNt), sous l’influence d’une aminoacyl ARNt synthétase.
Il existe 20 aminoacyl ARNt synthétases qui activent spécifiquement chaque acide aminé.
Après activation de l’acide aminé, les étapes de la synthèse protéique se succèdent.
Il existe 3 étapes successives :
●Transcription de l’ADN en ARN messager
Elle est catalysée par une ARN polymérase.
●Traduction de l’ARN messager en un peptide
La traduction se fait par des ribosomes. Il y a plusieurs ribosomes sur un même brin d’ARN messager, ce
dernier peut être traduit simultanément par différents ribosomes.
●Maturation
Le peptide va prendre sa forme finale dans l’appareil de Golgi et dans le RE. Il va acquérir sa structure tertiaire
ou quaternaire, il peut par exemple subir des phénomènes de glycosylation.
Pendant la maturation, des transformations d’acides aminés peuvent se produire: par exemple,
l’histidine peut être méthylée, ce qui la transforme en 3 méthyl histidine.
Après l’étape de maturation, la protéine finale est obtenue.
b) Dégradation irréversible des acides aminés
La dégradation irréversible des acides aminés correspond au catabolisme oxydatif de ces acides aminés.
Attention de ne pas la confondre avec la protéolyse qui est une autre voie de catabolisme.
➔Pour la dégradation irréversible des aa, les substrats dégradés sont des acides aminés libres
➔Pour la protéolyse, les substrats dégradés sont des protéines entières
Il y a 2 étapes dans cette dégradation dont le résultat final est la production d’urée.
1 ere
étape : c’est une étape de désamination.
Le résidu aminé d’un aa (le groupement α aminé) va être transféré sur un α céto glutarate ce qui donne un céto
acide (céto AA) et un glutamate. Les formules ne sont pas à savoir et servent simplement pour la
compréhension
2/8

NUTRITION – Métabolisme des protéines et cycles de l’urée, moyens d'étude
2ème étape : élimination de l’azote
Le glutamate formé pendant l’étape 1 va être transformé en glutamine, qui est elle-même transformée en urée.
Cette étape de transformation du glutamate en glutamine est assurée par la glutamine synthétase.
Glutamate → glutamine → urée
Glutamine synthétase
Le produit final de la dégradation irréversible des acides aminés est donc l’urée. Celle-ci n’a pas de fonction
métabolique, elle est excrétée par les voies urinaires.
II. Production des acides aminés
a) La protéolyse
La protéolyse assure 75 % de la production des acides aminés +++
C’est à partir du pool de protéines que la majorité des acides aminés sont produits.
Il existe 3 systèmes protéolytiques :
Le système lysosomal
Il dégrade les protéines intracellulaires à demi-vie longue et il utilise les cathepsines comme enzymes
principales.
Ce système capte les protéines à dégrader, elles entrent dans les vésicules lysosomales puis sont détruites par
les cathepsines.
Le système calpaïne – calpastatine
Il dégrade les protéines du cytosquelette (actine, myosine).
L’enzyme principale de ce système c’est la calpaïne, qui est inhibée par la calpastatine. Elles agissent de
façon auto régulée pour assurer la stabilité du pool de protéines du cytosquelette ou sa dégradation en cas de
besoin.
Le protéasome
Il dégrade les protéines intracellulaires à demi-vie courte.
Le protéasome est un complexe enzymatique très volumineux. Les protéines à dégrader doivent être
marquées au préalable par une petite protéine que l’on appelle l’ubiquitine, c’est un système ubiquitine
dépendant.
L’ubiquitine est une protéine de 76 aa qui a une très forte constance de séquence dans les cellules
eucaryotes. Elle se lie avec les résidus lysines de la protéine à dégrader par l’intermédiaire d’une liaison
covalente. Le protéasome peut alors agir et dégrader la protéine marquée, ce qui entraîne une production
d’acides aminés et le relargage de l’ubiquitine.
C’est un système ATP- dépendant, il faut de l’énergie pour qu’il fonctionne.
3/8

NUTRITION – Métabolisme des protéines et cycles de l’urée, moyens d'étude
b) Apports exogènes
Ils sont responsables de 25% de la production d’acides aminés.
Les apports exogènes correspondent au contenu protéique de l’alimentation. Après consommation de
protéines, celles-ci vont être hydrolysées sur le plan digestif et transformées en acides aminés libres (en partie).
Sources alimentaires riches en protéines :
➔Les viandes
➔Les poissons
➔Les produits laitiers
➔Les œufs
On consomme environ 1.5 grammes par kilo et par jour de protéines, ce qui fait entre 70 et 100 g de protéines
par jour.
c) Synthèse de Novo endogène des AA non essentiels
Il existe 20 acides aminés, qui sont classés en 2 types : acides aminés essentiels et acides aminés non essentiels.
Un acide aminé essentiel est un acide aminé qui ne peut être apporté que par l’alimentation, l’organisme n’est
pas capable de le synthétiser.
Il existe 9 acides aminés essentiels :
◦Histidine
◦Leucine
◦Isoleucine
◦Valine
◦Lysine
◦Méthionine
◦Phénylalanine
◦Tryptophane
◦Thréonine
Un acide aminé non essentiel peut être apporté par l’alimentation mais peut aussi être synthétisé par
l’organisme.
Il existe 11 acides aminés non essentiels :
◦Alanine
◦Glutamine
◦Glutamate
◦Aspartate
◦Asparagine
◦Cystéine
◦Proline
◦Glycine
◦Arginine
◦Tyrosine
◦Sérine
2 acides aminés non essentiels sont importants :
➔L’alanine car c’est un acide aminé néo gluco formateur : à partir d’alanine, on peut aboutir à la synthèse
de glucose.
➔La glutamine car c’est le substrat énergétique majoritaire de l’intestin.
4/8

NUTRITION – Métabolisme des protéines et cycles de l’urée, moyens d'étude
B) Moyens d'études du métabolisme des protéines
Les protéines sont importantes sur le plan métabolique. Elles correspondent à la masse maigre c’est-à-
dire à la masse vitale qui permet de nous défendre contre les agressions, d’assurer un métabolisme de base, de
lutter contre les infections.
Il faut maintenir un niveau de masse maigre ou masse protéique correct. L’apport en protéines exogènes
et tout le métabolisme protéique permettent de conserver une stabilité de pool ente les protéines et les acides
aminés.
Il existe 3 moyens d’études du métabolisme des protéines :
I. Quantification de la masse protéique totale
L’impédancemétrie permet de connaître les pourcentages de masse grasse et de masse maigre d’un
individu grâce à l’utilisation d’un impédance-mètre.
Au sein de la masse maigre, les quantités d’eau, de calcium, de protéines peuvent être mesurées. Ce
n’est pas un examen de routine mais la masse protéique totale d’une personne peut être connue assez
précisément.
Souvent, on dit que la masse protéique est égale à la masse musculaire, ce n’est pas tout à fait exact, c’est un
abus de langage.
Globalement on considère que la masse musculaire correspond à la masse protéique. (En réalité, la masse
protéique est plus importante que la masse musculaire puisque l’on trouve des protéines dans les os, pas
uniquement dans les muscles)
II. Bilan azoté dans le cas d'une nutrition artificielle
Il existe différents types de nutrition artificielle pour les personnes qui ne s’alimentent plus :
➔Nutrition entérale avec une sonde
➔Nutrition parentérale lorsque la nutrition entérale est impossible
Le bilan azoté permet d’apprécier l’efficacité de la nutrition artificielle : savoir si les apports protéiques sont
satisfaisants, par exemple.
Le bilan azoté correspond à la différence entre :
l’apport azoté (globalement c’est l’apport en protéines)
et les pertes azotées qui sont :
· Urinaires : 90%
· Fécales : 10 à 15%
· Sueur et desquamation de phanères : 0%, quantité négligeable
On considère par extrapolation que l’urée excrétée dans les urines correspond aux pertes azotées.
Pour mesurer ces pertes azotées, il suffit de mesurer l’urée dans les urines du patient pendant 3 à 5 jours
consécutifs, en faisant des recueils d’urines sur 24h chaque jour.
5/8
 6
6
 7
7
 8
8
1
/
8
100%