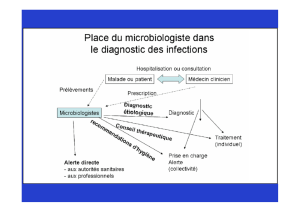
L1. PRÉLÈVEMENTS BACTÉRIENS

101-NE2-LG Microbiologie et biotechnologies - ESP Hiver 2015
Page 1 sur 2
Bactériologie
L1. PRÉLÈVEMENTS BACTÉRIENS
1. OBJECTIFS
S’initier à une méthode classique de prélèvement bactérien.
Observer l’abondance relative des bactéries selon les milieux.
2. INTRODUCTION – Une histoire de gélose [1; p.11]
Culture sur gélose. On étudie les bactéries grâce à une méthode de culture très simple inventée dans les
années 1880 par l’allemand Robert Koch. En vingt ans, elle a permis d’identifier les
bactéries responsables des grandes épidémies de l’époque : lèpre, tuberculose,
choléra, gonorrhée, etc. Il suffit de
1o Disperser un prélèvement à la surface d’une «gélose», i.e. un gel coulé dans une
boîte de Pétri et contenant des substances nutritives.
2o Incuber à une température appropriée afin que les bactéries se multiplient et
forment des colonies visibles à l’œil nu après quelques heures.
Autres contributions historiques. Il faut retenir certains apports préalables importants :
1850, Louis Pasteur développe les procédés de croissance bactérienne en milieu liquide. Les bactéries
humaines sont cultivées avec des extraits animaux (bouillon de viande) à des températures de 30°-35°.
1867, Joseph Lister instaure des techniques de chirurgie en asepsie dans le but de prévenir les
infections : stérilisation des instruments, désinfection des surfaces, rapidité d’exécution, etc.
1880, Walther Hess utilise l’agar, une protéine d’algue marine, pour gélifier les milieux de culture.
Contrairement à la gélatine, une protéine d’origine animale, l’agar ne fond pas au cours d’une
incubation à 35° car son point de fusion est de 45°. L’importance du milieu gélifié tient au fait que sa
surface permet de séparer et d’isoler les bactéries, ce qui est impossible en bouillon liquide.
1887, J.R. Pétri, alors assistant de Robert Koch, invente le contenant aujourd’hui appelé Boîte de Pétri,
lequel présente une surface assez grande, idéale pour disperser et séparer les bactéries.
Cultures pures. Robert Koch et son équipe peuvent alors prélever des colonies isolées à la surface des
géloses et mettre au point des cultures pures, permettant d’analyser un seul type de bactérie à la fois.
3. MANIPULATIONS
3.1. Choix de prélèvements. Chaque équipe de 2 étudiants effectue 4 prélèvements :
2 prélèvements de la flore bactérienne humaine : bouche et surface au choix (ex. bras)
2 prélèvements de surfaces de l’environnement au choix (ex. table, plancher, robinet, etc.)
Sécurité au laboratoire
Sarrau
Port du sarrau obligatoire.
Contamination
Bactéries : éviter de se contaminer ou de contaminer des objets ou le labo.
En cas de doute, nettoyer soigneusement.
Asepsie
Nettoyer le plan de travail et les mains avant et après le labo.
Brûleur
Surveiller les becs de gaz. Ajuster le brûleur avec soin. Attacher les cheveux.
Rappel
Comme toujours, il est interdit de manger ou de boire au labo.
Cellule buccale. Élève de
Lionel-Groulx. G: 1000X
Ensemencement avec
écouvillon sur gélose
en boîte de Pétri.

101-NE2-LG Microbiologie et biotechnologies - ESP Hiver 2015
Page 2 sur 2
ex.
bras
Gr
Date
bouche
Flore humaine
Équipe
Init
ex.
table
Surfaces environnement
ex.
plancher
Gr
Gr
Date
Équipe
Init
3.2. Identification des géloses en boîtes de Pétri
NB. On identifie une boîte de Pétri sur le fond et non sur le couvercle car il faut la disposer
à l’envers une fois ensemencée. Pourquoi? Il se forme souvent de la condensation à
l’intérieur du couvercle et des gouttes d’eau pourraient alors tomber sur le gel et empêcher
la formation de colonies isolées de bactéries.
Avec un marqueur, 2 géloses en 2 moitiés. Chaque partie
servira à étaler un prélèvement distinct.
Inscrire:
- Les prélèvements prévus selon les choix d’équipe.
- Infos de routine: groupe, date, équipe, initiales.
3.3. Prélèvements
Bactéries de l’air (en démo). Laisser deux géloses exposées à l’air du local pendant 15 minutes.
Bactéries de la flore humaine et de surfaces de l’environnement.
Suivre les consignes générales suivantes :
1) Juste au moment du prélèvement, déballer un écouvillon stérile.
2) Pour une surface humide (bouche), utiliser l’écouvillon tel quel. Pour une surface sèche (bras,
plancher) humecter rapidement l’écouvillon dans le la saline stérile.
3) Prélever sur une surface en frottant 2-3 stries tout en faisant
tourner l’écouvillon sur lui-même.
4) Ouvrir la gélose le moins longtemps possible, uniquement pour
étaler le prélèvement.
5) Rapidement, étaler le prélèvement sur toute la demi-surface de la
gélose correspondante en effectuant une striation serrée tout en
faisant tourner l’écouvillon sur lui-même.
6) Une fois les deux étalements complétés, sceller la gélose au papier
Parafilm et incuber à l’envers 24 hres à 37o.
4. RÉSULTATS
Pour chacun des prélèvements, évaluer le nombre relatif de colonies formées (de 0 à +++++) et, si
possible, le nombre de types de microorganismes différents observés selon l’apparence des colonies.
Prélèvement
Nb relatif de colonies
Nb de Types de
microorganismes
0, +, ++, +++, ++++, +++++
Bouche
5. MÉDIAGRAPHIE
1. Tortora G.J. et coll. (2012). Introduction à la microbiologie. 2e éd., ERPI, 832 p.
__________________________
1
/
2
100%