Documents de Physique-Chimie – M. MORIN 1 Thème : Lois et

Documents de Physique-Chimie – M. MORIN
1
Thème : Lois et modèles
Partie : Temps et évolution chimique.
Cours 2 : Cinétique et catalyse
I. Qu’est-ce qu’une transformation lente ?
1. La qualification lente ou rapide dépend de la technique de mesure utilisée.
Si la grandeur mesurée ne change pas de façon significative pendant la durée de la mesure, on qualifie la réaction de
lente.
2. Exemples de transformations chimiques observées à l’œil.
Ranger dans la colonne correspondante les transformations chimiques suivantes :
- Formation de la rouille.
- Formation d’un précipité de chlorure d’argent.
- Synthèse d’un ester tel que l’acétate de linalyle (odeur de lavande)
- Décomposition de l’eau oxygénée.
- Combustion du méthane.
- Réaction entre l’acide chlorhydrique et la soude.
Réactions rapides
Réactions lentes
Réponses :
Réactions rapides
Réactions lentes
Formation d’un précipité de chlorure d’argent
Formation de la rouille
Combustion du méthane
Décomposition de l’eau oxygénée
Réaction entre l’acide chlorhydrique et la soude
Synthèse d’un ester tel que l’acétate de linalyle
Instrument de mesure
Durée de la mesure
Œil
1 s
Conductimètre
0,1 s
pH-mètre
Quelques secondes

Documents de Physique-Chimie – M. MORIN
2
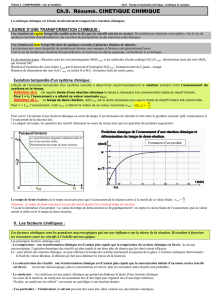
II. Influence des facteurs cinétiques sur la vitesse de réaction.
La mise en évidence expérimentale de l’influence des facteurs cinétiques aura été réalisée en TP.
1. La température est un facteur cinétique.
Une transformation chimique est d’autant plus rapide que la température des réactifs est élevée.
1.1. Un peu de théorie : (Hors programme)
La transformation chimique (rupture et formation de liaisons) ne peut avoir lieu que si les molécules se
rencontrent.
Afin de déterminer le pourcentage de collisions efficaces, on calcule le nombre de collisions se produisant
entre deux espèces chimiques et on le compare au nombre de molécules transformées.
Ordre de gradeur : Pour une réaction chimique telle que H2 + I2 2 HI, réalisée à 400 °C, le nombre de
collisions efficaces n’est que de
Les espèces chimiques sont assimilées à des sphères indéformables, indépendantes les unes des autres.
L’énergie cinétique des espèces entrant en collision doit être suffisante pour passer la barrière d’énergie.
La température augmente les mouvements browniens des molécules, donc la probabilité des collisions.
1.2. Illustrations dans la vie courante :
- Cuisson à l’autocuiseur.
- conservation des aliments par le froid.
1.3. Applications au laboratoire :
- Chauffage pour accélérer la réaction.
- Trempe (bain d’eau froide) pour stopper la réaction.

Documents de Physique-Chimie – M. MORIN
3
2. La concentration des réactifs est un facteur cinétique.
Une transformation chimique est d’autant plus rapide que la concentration des réactifs est grande.
2.1. Un peu de théorie (Hors programme).
Plus la quantité de réactifs est élevée par unité de volume, plus les molécules sont proches les unes des autres,
plus la probabilité de collisions efficaces augmente.
2.2. Applications au laboratoire :
L’augmentation de la concentration des réactifs augmente la vitesse de réaction.
La dilution : en diminuant la concentration des réactifs, on peut ralentir ou stopper une réaction.
Remarque : si l’on verse de l’eau froide dans un milieu réactionnel, on fait intervenir les deux facteurs
cinétiques (trempe + dilution).
3. Nature du solvant.
La nature du solvant influe sur la vitesse de réaction. La polarité (polaire ou apolaire) du solvant peut influer sur la
vitesse de réaction. L’aptitude du solvant à créer des liaisons hydrogène (protique ou aprotique) peut également
influer sur la vitesse de réaction.
3.1. Un peu de théorie (Hors programme).
Un solvant se caractérise par plusieurs grandeurs physiques :
- La constante diélectrique
qui donne l’aptitude de la molécule de solvant à se polariser sous l’action d’un
champ électrique créé par une autre molécule.
Exemple : La réaction suivante C2H5I + N(C2H5)3 → [N(C2H5)4]+ I- est 530 fois plus rapide dans l’acétone
CH3-CO-CH3 (
élevée) que dans l’hexane CH3-CH2-CH2-CH2-CH2-CH3 (
faible).
Si
augmente, alors la vitesse de réaction augmente.
- La force ionique I qui est une grandeur assimilable à une concentration qui tient compte en plus des charges
des ions.
Si la force ionique d’un solvant est plus élevée, la vitesse de réaction augmente.
- La viscosité
qui caractérise l’aptitude du solvant à offrir une résistance au mouvement des autres molécules.
Si la viscosité augmente, la vitesse de réaction diminue.
3.2. Les solvants les plus utilisés au laboratoire.
- Les solvants apolaires.
o Hexane CH3-CH2-CH2-CH2-CH2-CH3
o Cyclohexane C6H12
- Les solvants polaires-aprotiques.
o Acétone CH3-CO-CH3
o Dichlorométhane CH2Cl2
- Les solvants polaires-protiques.
o Ethanol CH3-CH2-OH
o Eau H2O

Documents de Physique-Chimie – M. MORIN
4
III. Evolution d’une quantité de matière au cours du temps. Temps de demi-réaction.
Evolution d’une quantité de matière au cours du temps.
A partir de l’étude du graphique suivant, proposer une description de l’évolution de la quantité de matière
produite au cours du temps.
Proposer une définition du temps de demi-réaction, noté t1/2.
La quantité de matière augmente au cours du temps.
La vitesse de réaction qui peut être représentée par le coefficient directeur en un point de la courbe diminue au
cours du temps.
En effet, plus le temps passe moins il y a de réactifs. La probabilité de collision diminue.
Le temps de demi-réaction est la durée au bout de laquelle la moitié de la quantité maximale de produit a été
formé.
Dans ce cas, le temps de demi-réaction est égal à t1/2 = 10 s qui correspond à une quantité de matière
n =
4,5 mol.
Plus le temps de demi-réaction est faible, plus la réaction est rapide.

Documents de Physique-Chimie – M. MORIN
5
IV. Catalyse homogène, hétérogène et enzymatique.
1. Définition d’un catalyseur.
Objectif : Donner une définition d’un catalyseur à partir d’un exemple.
Réaction : On étudie la réaction de décomposition du peroxyde d’hydrogène : 2 H2O2 O2 + 2 H2O
Peroxyde d’hydrogène H2O2 à 33%, 130 V.
Quel matériel choisir ?
Quel catalyseur choisir parmi les objets présents autour de vous ?
Quel protocole mettre en place ?
Que faut-il observer ?
Proposition de mise en évidence de l’action d’un catalyseur :
Matériel :
- Des tubes à essais.
- Des gants, des lunettes de protection, une blouse.
- Du peroxyde d’hydrogène.
Quel catalyseur choisir ?
- une règle métallique (la plupart des métaux de transition catalysent cette réaction)
- un morceau de viande (contient une enzyme, la catalase).
- Catalyseur proposé par le professeur : solution de sulfate de fer III ou fil de platine Pt.
Quel protocole mettre en place ?
- Préparer un tube témoin contenant du peroxyde d’hydrogène.
- Préparer un tube contenant du peroxyde d’hydrogène auquel on ajoute le catalyseur.
Observations :
- On constate la formation de petites bulles de dioxygène dans le tube contenant le catalyseur.
- On constate que le catalyseur n’est pas consommé lors de la réaction.
Proposition de définition :
Un catalyseur est une substance chimique qui accélère une transformation chimique, sans être consommé et
qui est retrouvé inchangé à la fin de la réaction.
Il n’apparaît pas dans l’équation-bilan.
 6
6
 7
7
 8
8
1
/
8
100%