Guide d`utilisation du bévacizumab (Avastin) pour le traitement du

Guide d’utilisation du bévacizumab (Avastin)
pour le traitement du cancer colorectal métastatique
Comité de l’évolution des pratiques en oncologie
(CÉPO)
Janvier 2006

Ce
g
uide constitue un outil d’aide à la décision clinique fondé sur les données probantes. Il
a été élaboré par le Comité de l’évolution des pratiques en oncologie en partenariat avec
des cliniciens experts. Son contenu n’engage que ses auteurs.
Il ne se substitue pas à la Liste de médicaments - établissements prévue à l’article 116 de
la Loi sur les Services de Santé et les Services sociaux, lequel constitue le cadre général
de la fourniture de médicaments dans les établissements de santé.

3
CÉPO-2006-01
GUIDE D’UTILISATION DU BÉVACIZUMAB (AVASTIN®)
POUR LE TRAITEMENT DU CANCER COLORECTAL MÉTASTATIQUE
RÉSUMÉ
Au cours des dernières décennies, la chimiothérapie du cancer colorectal métastatique a reposé sur le
fluorouracile (5-FU) avec ou sans leucovorin (LV). Peu de progrès ont été accomplis sur le plan clinique
durant cette période. L’arrivée de l’irinotécan (CPT-11) et de l’oxaliplatine dans l’arsenal thérapeutique a
constitué une percée majeure. L’inhibition spécifique du facteur de croissance vasculaire
endothélial (vascular endothelial growth factor, VEGF) avec le bévacizumab est l’une des nouvelles
approches les plus prometteuses. Le bévacizumab a été approuvé par Santé Canada en septembre 2005
en association avec une chimiothérapie à base de fluoropyrimidine dans le traitement de première intention
du carcinome métastatique du côlon ou du rectum.
Bon nombre de conclusions peuvent être tirées des études portant sur le bévacizumab. Lorsqu’il est utilisé
en association avec une chimiothérapie de première intention du cancer colorectal métastatique à base de
5-FU/LV, le bévacizumab améliore les résultats cliniques, dont la survie médiane. Il est actif en deuxième
intention chez des patients n’ayant pas reçu de bévacizumab en première intention. Les études n’ont pas
démontré d’activité du bévacizumab en monothérapie. Il n’y a pas de données probantes justifiant
l’utilisation de bévacizumab en troisième intention ou plus.
Des effets indésirables particuliers sont associés à l’administration de bévacizumab, le plus fréquent étant
l’hypertension de grade 3. Elle est généralement bien contrôlée avec la prise de médication standard.
L’incidence d’événements thromboemboliques artériels est augmentée chez les patients recevant du
bévacizumab et nécessite une attention particulière, surtout chez les patients de 65 ans et plus, et ceux
ayant des antécédents d’athérosclérose. Bien que rares, des perforations intestinales ont été rapportées
parmi les patients ayant été traités avec le bévacizumab et ont été fatales dans quelques cas.
Après analyse des données probantes disponibles, le Comité de l’évolution des pratiques en oncologie
recommande, pour le traitement des patients ayant un cancer colorectal métastatique :
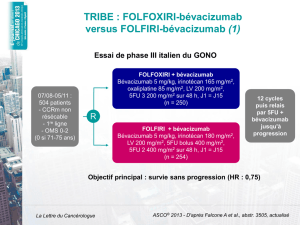
- d’offrir le bévacizumab à 5 mg/kg aux deux semaines en première intention en association
avec une combinaison de 5-FU/LV et d’irinotécan (IFL ou FOLFIRI) (recommandation de
grade A) ;
- de considérer comme une option acceptable en première intention :
o le FOLFOX + bévacizumab à 5 mg/kg aux deux semaines chez les patients ne pouvant
pas recevoir de l’irinotécan (données non publiées1);
o le 5-FU/LV + bévacizumab à 5 mg/kg aux deux semaines (recommandation de
grade A). Cette recommandation s’applique seulement chez les patients ne pouvant
pas recevoir de l’irinotécan ou de l’oxaliplatine ;
1 À confirmer lors de la publication d’études à venir.

4
- de considérer comme une option thérapeutique l’utilisation de bévacizumab à 10 mg/kg aux
deux semaines en deuxième intention en association avec une chimiothérapie comportant du
5-FU/LV et de l’oxaliplatine ou de l’irinotécan chez les patients n’ayant pas reçu de
bévacizumab antérieurement (données non publiées);
- de ne pas utiliser le bévacizumab après la deuxième intention de traitement (données
préliminaires non publiées) ;
- de ne pas utiliser le bévacizumab en monothérapie (données non publiées) ;
- de porter une attention particulière aux effets indésirables rares mais graves associés à
l’utilisation du bévacizumab, particulièrement les événements thromboemboliques artériels et
les perforations intestinales, et d’informer les patients des risques potentiels du traitement.

5
CÉPO-2006-01
GUIDELINES FOR THE TREATMENT OF METASTATIC COLORECTAL CANCER
WITH BEVACIZUMAB (AVASTIN®)
SUMMARY
For several years, the systemic treatment of patients with metastatic colorectal cancer was based on
5-fluorouracil (5-FU) with or without leucovorin (LV). The first breakthrough occurred with the addition of
irinotecan (CPT-11) and oxaliplatin, setting new combinations of drugs as standard of care. The specific
inhibition of the vascular endothelial growth factor (VEGF) with bevacizumab is a very promising new
approach. In September 2005, it was approved by Health Canada in combination with a fluoropyrimidine-
based chemotherapy, for first line treatment of metastatic colorectal cancer.
Evaluation of available date on the use of bevacizumab in metastatic colorectal cancer lead to the following
conclusions :
1. When used in combination with 5-FU/LV-based first line therapy, bevacizumab improves clinical
outcomes including median survival.
2. It is active in second line treatment in patients who had never been exposed to it previously.
3. There is no data to support its use as a monotherapy or in third line therapy regimens.
Specific bevacizumab related adverse reactions have been identified, the most common being grade 3
hypertension. However, it is well controlled with standard medication. Other side effects requiring special
attention include arterial thromboembolic events, especially in patients 65 years of age or older and those
with history of atherosclerosis. Also, however rare, is the risk of intestinal perforation with possible death.
Based on the analysis of available evidence, the Comité de l’évolution des pratiques en oncologie
recommends for the treatment of patients with metastatic colorectal cancer
- That bevacizumab at 5 mg/kg every two weeks in association with a first line chemotherapy
regimen of 5-FU/LV and irinotecan (IFL or FOLFIRI) be offered to patients (grade A
recommendation)
- To consider as acceptable first line treatment options:
o FOLFOX + bevacizumab at 5 mg/kg every two weeks in patients who could not receive
irinotecan (unpublished data2)
o 5-FU/LV + bevacizumab at 5 mg/kg every two weeks (grade A recommendation). This
recommendations is applicable only in patients who could not receive irinotecan or
oxaliplatin.
- To consider as a therapeutic option the use of bevacizumab at 10 mg/kg every two weeks in
association with a second line chemotherapy regimen of 5-FU/LV plus oxaliplatine or irinotecan
in patients unexposed to first line bevacizumab (unpublished data)
- To not use bevacizumab after second line treatment (unpublished preliminary data)
2 To be confirmed with the publication of forthcoming studies.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
1
/
32
100%