Effets du stress sur la régulation glycémique

DANS LES PATHOLOGIES RENCONTREES EN URGENCES,
DOIT-ON S'OCCUPER DU CONTROLE DE LA GLYCEMIE EN
PRIORITE (EN DEHORS DU DIABETIQUE)?
Jean-Christophe Orban, Carole Ichai
Service de Réanimation médico-chirurgicale, Hôpital Saint-Roch, CHU de Nice.
Correspondance à adresser : Dr Jean-Christophe Orban, Service de Réanimation médico-
chirurgicale. Hôpital Saint-Roch, 5 rue Pierre Dévoluy. 06006 NICE Cedex 1
Tel : 04 92 03 33 00, Fax : 04 92 03 35 58, @mail : [email protected]

Régulation glycémique
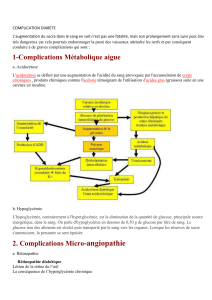
La glycémie varie physiologiquement dans des limites étroites : 4 à 5 mmol/L à jeun et 7 à
8 mmol/L après un repas. Elle résulte d’un équilibre entre flux entrant dans l’organisme (apport
exogène et production endogène) et flux sortant (oxydation, stockage et excrétion).
La production endogène de glucose est de l’ordre de 1,8 à 2,3 mg/kg/min chez l’adulte et
dépend du foie et des reins. La majorité de cette production endogène est d’origine hépatique,
provenant pour 50 à 70 % de la glycogénolyse et pour 10 à 20 % de la néoglucogenèse à partir du
lactate, du pyruvate et des acides aminés glucoformateurs [1, 2].
Le contrôle de la glycémie est régulé par des interactions entre des mécanismes
hormonaux, neurologiques et l’autorégulation hépatique. L’insuline est la seule hormone
hypoglycémiante, elle agit en augmentant la captation périphérique du glucose, en favorisant la
glycogénogenèse et en diminuant la néoglucogenèse. Les hormones hyperglycémiantes ou de
contre-régulation, glucagon, adrénaline, cortisol et hormone de croissance, ont des effets inverses
de ceux de l’insuline. La régulation nerveuse de la glycémie passe par des récepteurs centraux et
périphériques et agit sur la libération des hormones impliquées dans le métabolisme glucidique :
insuline, catécholamines. Enfin une partie de la production hépatique de glucose n’est pas sous
dépendance hormonale, il s’agit de l’autorégulation hépatique qui maintien un débit de glucose
en fonction de la glycémie et d’autres facteurs comme le niveau de réserve en glycogène.
Effets du stress sur la régulation glycémique
Lors d'un stress, il y a augmentation des hormones de contre-régulation : cortisol,
catécholamines, hormone de croissance. Ceci aboutit à une hyperglycémie par plusieurs
mécanismes. Ces hormones facilitent la glycogénolyse et diminuent la mise en réserve du glucose
sous forme de glycogène. De plus elles induisent une insulino-résistance se caractérisant par une
baisse de l'utilisation du glucose. Durant cet état l'insulinémie est augmentée car son action est
diminuée. L'inflammation est aussi responsable de la genèse d'un état d'insulino-résistance. En
effet, les cytokines de l'inflammation altèrent la signalisation insulinique à différent niveaux. Par
exemple le TNF-α phosphoryle les substrats du récepteur de l'insuline sur des résidus sérine
aboutissant à une diminution du signal [3]. L'interleukine 6 va agir au niveau nucléaire avec les

mêmes résultats [4]. On rentre dans un véritable cercle vicieux car l'inflammation conduit à
l'hyperglycémie qui a aussi des effets pro-inflammatoires [5, 6].
Pourquoi s'intéresser au contrôle glycémique?
Toutes les situations de stress sont associées à des degrés divers à une hyperglycémie.
Pendant longtemps cette hyperglycémie a été tolérée, pensant qu'elle était moins délétère que
l'hypoglycémie. Néanmoins, dans certaines pathologies l'hyperglycémie était associée à un
mauvais pronostic sans que l'on puisse établir une relation de cause à effet. Le travail de Van Den
Berghe en 2001 a établi les bases du contrôle glycémique en montrant l'intérêt d'un contrôle strict
de la glycémie en réanimation [7]. Depuis lors, cette thérapeutique adjuvante est l'objet de
nombreuses controverses avec des publications montrant des résultats contradictoires [8, 9]. De
plus un certain nombre de questions restent en suspens concernant la cible glycémique à atteindre
et dans quel délai, les patients pouvant en bénéficier, le type de pathologies traiter et les effets
secondaires tels que l'hypoglycémie.
Le contrôle glycémique dans certaines pathologies aux Urgences
L'infarctus du myocarde
L'hyperglycémie est un facteur de mauvais pronostic après infarctus du myocarde. Cela a
été largement montré chez le diabétique mais c'est aussi le cas chez le non diabétique [10]. Dans
cette population, les patients ayant les hyperglycémies les plus élevées après IDM avaient un
risque plus important de développer un choc cardiogénique ou une insuffisance cardiaque et de
décéder. Dans la population de patients âgés ayant présenté un IDM, on retrouvait une
augmentation graduelle de la mortalité à 30 jours allant de 10% pour les glycémies inférieures à
110 mg/dl jusqu'à à 39% pour celles supérieures à 240 mg/dl [11]. La mortalité à un an montrait
les mêmes différences en fonction de la glycémie à l'admission. De plus, à niveau
d'hyperglycémie égale la mortalité était supérieure chez les non diabétiques par rapport aux
diabétiques. Ce dernier résultat s'expliquait probablement par une prise en charge de
l'hyperglycémie moins agressive chez les patients non diabétiques. En effet, pour les mêmes
niveaux d'hyperglycémie, les non diabétiques recevaient moins d'insuline que les diabétiques.

Enfin une méta-analyse retrouvait un risque de décès près de 4 fois supérieur chez les non
diabétiques lorsqu'une hyperglycémie de stress était présente à l'admission [10].
Si l'hyperglycémie est clairement associée à un mauvais pronostic après IDM, l'intérêt de
la correction de celle-ci reste débattu. La première étude réalisée en 1995 (DIGAMI 1), a
comparé les effets d'un contrôle glycémique vs traitement standard chez 306 patients diabétiques
présentant un IDM [12]. L'insulinothérapie était réalisée par administration de GIK pendant 48 h
puis le contrôle glycémique était poursuivi dans les jours suivants par de l'insuline sous-cutanée
et maintenu pendant 3 mois après la sortie de l'hôpital. Cette procédure permettait d'obtenir une
diminution significative de la glycémie par rapport au groupe contrôle à 24 heures (9,6 mmol/L
vs 11,7 mmol/L), à la sortie de l'hôpital (8,2 mmol/L vs 9,0 mmol/L) et à 3 mois (8,5 mmol/L vs
9,0 mmol/L). La mortalité à 1 an était de 18,6% dans le groupe traité par insuline vs 26,1% dans
le groupe contrôle, ce qui correspondait à une baisse significative du risque relatif de 29%. Par
ailleurs, il existait une baisse significative du risque de récidive et de survenue d'insuffisance
cardiaque dans le groupe bénéficiant de l'insulinothérapie. Pour déterminer le rôle respectif du
contrôle glycémique aigu par rapport au contrôle chronique, les mêmes auteurs ont réalisés une
autre étude en 2005 (DIGAMI 2) [13]. Pour cela, 3 groupes de patients étaient comparés : un
groupe traité par GIK durant 24 heures suivi par un contrôle glycémique par insuline à long terme
(n = 474), un groupe traité par GIK (glucose-insuline-potassium) pendant 24 heures (n = 473) et
un groupe contrôle sans GIK (n = 306). Aucune différence en termes de mortalité à 3 ans et de
morbidité (récidive d'IDM, AVC ischémique) n'avait été mise en évidence. Mais, cette étude
présentait de nombreux biais méthodologiques : seuil de normoglycémie non obtenu dans le
premier groupe, pas de différence de niveau moyen de glycémie à long terme entre les 3 groupes,
arrêt des inclusions prématuré. Ces résultats soulignent que la perfusion de glucose-insuline-
potassium (GIK), n'a probablement pas d'effet bénéfique si le niveau glycémique n'est pas
contrôlé. Chez le non diabétique, aucune étude n'a évalué l'intérêt du contrôle glycémique après
IDM.
L'hyperglycémie est associée à un mauvais pronostic après IDM. Il est possible que la
correction de cette hyperglycémie puisse avoir des bénéfices mais de futures études sont
indispensables pour l'affirmer.

Les accidents vasculaires cérébraux
Les données concernant l'association de l'hyperglycémie à un mauvais pronostic après
accident vasculaire cérébral sont relativement récentes. Une revue de la littérature a colligé 32
cohortes s'intéressant à l'hyperglycémie de stress après accident vasculaire cérébral [14]. Chez les
non diabétiques, l'hyperglycémie était associée à un risque relatif de décès 3 fois supérieur. Chez
les diabétiques on ne retrouvait pas de surmortalité en présence d'une hyperglycémie. Après AVC
ischémique, il existait une surmortalité en présence d'une hyperglycémie dans les groupes
diabétiques et non diabétiques. Par contre l'hyperglycémie n'était pas associée à une
augmentation de la mortalité après AVC hémorragique. En termes de récupération fonctionnelle
chez les survivants l'hyperglycémie à l'admission était aussi un facteur de mauvais pronostic.
S'il est bien établi que l'hyperglycémie est associée à un mauvais devenir après un
accident vasculaire cérébral, la correction de celle-ci est plus débattue. Deux grandes études ont
évalué le GIK pour corriger l'hyperglycémie après AVC [15, 16]. Dans l'étude GIST, du GIK
était donné durant les 24 premières heures pour maintenir une glycémie capillaire entre 4 et 7
mmol/L correspondant à une glycémie plasmatique entre 4,6 et 8 mmol/L [15]. Dans le groupe
recevant le GIK, il n'y avait pas de bénéfice par rapport au groupe contrôle. Ceci pourrait être en
partie expliqué par le faible effectif de l'étude (53 patients) mais surtout par l'absence de
différence significative en termes de glycémie entre les deux groupes. Une seconde étude GIST a
été menée plus récemment avec un design proche mais un effectif plus important [16]. Dans
celle-ci, la glycémie était significativement inférieure dans le groupe GIK (0,57 mmol/L de
moins). Cependant il n'existait aucune différence significative entre les deux groupes en termes
de mortalité et de devenir. Ici encore, ces résultats pouvaient être expliqués par un manque de
puissance de l'étude par rapport à l'effectif qui avait été calculé.
A ce jour 3 études ont évalué la correction de l'hyperglycémie après AVC avec une
insulinothérapie, deux ont été publiée et la troisième est en cours de publication [17]. Elles
montrent un meilleur contrôle glycémique lors d'un traitement agressif de l'hyperglycémie.
Malheureusement ces travaux n'ont fait qu'évaluer la faisabilité de cette thérapeutique avec des
effectifs faibles. Elles confirment qu'il est possible de contrôler de manière stricte la glycémie
après AVC mais leur manque de puissance ne permet pas de tirer de conclusions concernant le
devenir des patients.
 6
6
 7
7
 8
8
 9
9
1
/
9
100%