insuffisance renale aigue du post partum pathologique

UNIVERSITE DU DROIT ET DE LA SANTE - LILLE 2
FACULTE DE MEDECINE HENRI WAREMBOURG
Année : 2013
T H E S E P O U R L E D I P L O M E D ’ E T A T
D E D O C T E U R E N M E D E C I N E
INSUFFISANCE RENALE AIGUE DU POST PARTUM PATHOLOGIQUE :
EPIDEMIOLOGIE, FACTEURS DE RISQUE ET EVOLUTION.
ANALYSE RETROSPECTIVE SUR 5 ANS DANS 3 SERVICES DE REANIMATION
Présentée et soutenue publiquement le 1er Juillet 2013
Au Pôle Recherche
Par Marie JONARD
Jury
Président :
Monsieur le Professeur FOURRIER François
Assesseurs :
Monsieur le Professeur JOURDAIN Mercé
Monsieur le Professeur HAZZAN Marc
Monsieur le Professeur SUBTIL Damien
Monsieur le Docteur PROVOT François
Directeur de Thèse :
Madame le Docteur DUCLOY Anne-Sophie

Sommaire
ABREVIATIONS .......................................................................................................................................... 3
INTRODUCTION ......................................................................................................................................... 4
I. Problématique de l’IRA liée à la grossesse: Epidémiologie et Etat des connaissances actuelles ...... 4
II. Etiologies de l’insuffisance rénale aiguë liée à la grossesse ............................................................... 5
III. Motifs de transfert en réanimation ...................................................................................................... 7
IV. But de l’étude ...................................................................................................................................... 8
MATERIELS ET METHODES .................................................................................................................... 9
I. Design de l’étude ................................................................................................................................ 9
II. Population étudiée .............................................................................................................................. 9
1. Critères d’inclusion ......................................................................................................................... 9
2. Critères d’exclusion : .................................................................................................................... 10
III. Variables étudiées ............................................................................................................................. 10
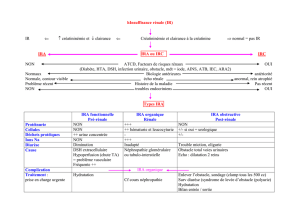
IV. Comment définir et diagnostiquer l’IRA chez la femme enceinte ................................................... 14
V. Définition des post partum pathologiques rencontrés en réanimation: pré éclampsie, HELLP
syndrome, éclampsie, SHAG et Hémorragie du post partum ................................................................. 16
VI. Hémostase et grossesse: de l’adaptation physiologique à la décompensation lors de la pré
éclampsie, du HELLP syndrome, du SHAG et de l’hémorragie de la délivrance. ................................. 20
VII. Analyses statistiques ....................................................................................................................... 22
RESULTATS ............................................................................................................................................... 23
I. Epidémiologie et Caractéristiques sur la période de 2008à 2012: .................................................... 23
1. Population des parturientes de la région ....................................................................................... 23
2. Population des post partum transférés en réanimation.................................................................. 23
3. Population des insuffisantes rénales aiguës des post partum admises en réanimation ................. 29
4. Epidémiologie de l’IRA, sa sévérité et son évolution:.................................................................. 38
III. Facteurs de risque d’insuffisance rénale aigue: comparaison de deux groupes: population IRA/
population NON IRA .............................................................................................................................. 39
1. Analyse univariée .......................................................................................................................... 39
2. Analyse multivariée ...................................................................................................................... 52
III. Facteurs de gravité : comparaison de trois groupes de sévérité : IRA1/IRA2/IRA3 en analyse
univariée .................................................................................................................................................. 53
IV. Evolution et pronostic ....................................................................................................................... 63
1. Groupe IRA1 ................................................................................................................................. 63
2. Groupe IRA2 ................................................................................................................................. 64
3. Groupe IRA3 ................................................................................................................................. 64

4. Détail des 8 cas d’insuffisance rénale chronique .......................................................................... 66
DISCUSSION .............................................................................................................................................. 68
I. Rappel des principaux résultats ........................................................................................................ 68
1. Epidémiologie ............................................................................................................................... 68
2. Facteurs associés à l’IRA .............................................................................................................. 69
3. Délais de récupération ................................................................................................................... 70
II. Discussion des résultats .................................................................................................................... 70
1. Epidémiologie ............................................................................................................................... 70
2. Discussion des principaux facteurs de risque associés a l’IRA .................................................... 72
3. Facteur protecteur : l’Hystérectomie d’hémostase ........................................................................ 81
III. Limites de notre étude ...................................................................................................................... 82
IV. Perspectives ...................................................................................................................................... 83
CONCLUSION............................................................................................................................................ 86
ANNEXES ................................................................................................................................................... 87
Bibliographie ............................................................................................................................................... 92

3
ABREVIATIONS
AG
Anesthésie Générale
ALR
Anesthésie Loco Régionale
CG
Culot Globulaire
CPA
Concentré de Plaquettes d’Aphérèse
HELLP
Hemolysis Elevated Liver Low Platelet
HPP
Hémorragie du Post Partum
HTA
Hypertension Artérielle
IEC
Inhibiteur de l’Enzyme de Conversion
IGS II
Indice de Gravité Simplifié
IRA
Insuffisance Rénale Aigue
IRC
Insuffisance Rénale Chronique
PE
Pré Eclampsie
PFC
Plasma Frais Congelé
PMA
Procréation Médicalement Assistée
SA
Semaine d’Aménorrhée
SAC
Sérum Albumine Concentrée
SAD
Sérum Albumine Diluée
SHAG
Stéatose Hépatique Aigue Gravidique
Score de l’ISTH
Score de Coagulation Intra Vasculaire Disséminée de l’International
Society for Thrombosis and Hemostasis
SCORE de RIFLE
Risk of renal dysfunction, Injury to the kidney, Failure of kidney function,
Loss of kidney function et End stage renal disease
VB
Voie Basse

4
INTRODUCTION
I. Problématique de l’IRA liée à la grossesse: Epidémiologie et Etat des
connaissances actuelles
Ces dernières décennies ont permis d’observer une nette diminution de l’insuffisance rénale aigue
(IRA) au cours de la grossesse. Depuis les années 1960, l’incidence a diminué de une grossesse sur 3000
à une grossesse sur 20000 aujourd’hui dans les pays développés (1). La forme la plus sévère de l’IRA est
la nécrose corticale. Il s’agit d’une destruction du cortex rénal secondaire à une ischémie rénale. La
population de femmes enceintes est plus susceptible de développer une nécrose corticale que le reste de la
population avec une incidence de 1 sur 80000 (2). Le recours à l’hémodialyse survient pour un cas sur
10000 à 20000 grossesses en cas de nécrose tubulaire aigue (3)(4)(5)(2).
Cependant, l’incidence de l’IRA varie de manière importante en fonction des études et ce pour
deux raisons principales (6). La première est l’absence de définition consensuelle de l’IRA. Pour certains,
l’IRA se diagnostique à partir d’une créatininémie supérieure à 8 mg/L et pour d’autres l’IRA se
détermine à partir du recours à l’épuration extra rénale. La seconde raison est la variabilité de son
incidence en fonction du niveau de développement du pays dans lequel l’étude a été réalisée. En effet,
l’incidence est plus élevée dans les pays en voie de développement. Dans une étude récente menée en
Inde, l’incidence de l’IRA liée à la grossesse a été retrouvée dans une à 50 grossesses. Celle-ci représente
plus de 20% des causes d’IRA globale (7). En revanche, l’accès aux soins, la prise en charge précoce des
toxémies gravidiques et la diminution des complications septiques dans les pays développés ont permis
un net recul de l’IRA.
Quelque soit le niveau de développement du pays, l’incidence des IRA va se répartir de manière
chronologique, plus particulièrement à la fin du troisième trimestre de grossesse et autour de
l’accouchement. Les étiologies de la défaillance rénale seront aussi variables en fonction du stade de la
grossesse.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
1
/
99
100%