La thrombose et le cancer

2017-01-26
1
LA THROMBOSE CHEZ LES PATIENTS
ATTEINTS DE CANCER
27 Janvier 2017
Dr. Karim Abou-Nassar, MD FRCPC
Hématologue et Directeur Axe de Recherche en cancérologie CISSSO
Professeur adjoint Université d’Ottawa
8e Congrès international
SUJETS DE
THROMBOSE ET
D’HÉMOSTASE
DANS LE CANCER
Du 8 au 10 avril 2016
Bergame, Italie

2017-01-26
2
Faits saillants
•Rappel de l’impact de la TEV pour les patients ayant
déjà une maladie potentiellement mortelle
•Les patients cancéreux doivent être informés des
signes/symptômes. risque et impact potentiel de la
TEV sur leur vie et bien comprendre la prise en
charge de leur TEV, le cas échéant
•Importance du suivi des preuves cliniques et de
l’application des lignes directrices en pratique, afin de
mieux prendre en charge la TEV chez les patients en
oncologie
TEV non provoquée :
patients non cancéreux

2017-01-26
3
Résumé de cas
58 ans, 190 kg
Antécédents
•
Gros fumeur dans la trentaine et la
quarantaine
Exam
•
Pression sanguine 142/87
•
Analyses labo. :
−Créatinine 90 μmol/L
−Hémoglobine 85 g/L
−Numér. plaquet. 130 x109
Médicaments actuels
•
Antihypertenseurs
•
Inhalateur MPOC
Comorbidités
•
Diagnostic de MPOC à 52 ans
•
Toux chronique
•
Hypertension
Joseph a une TEV non
provoquée
Feriez-vous un dépistage pour
le cancer?

2017-01-26
4
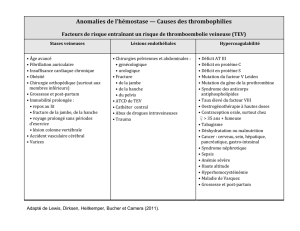
Facteurs de risque de TEV
•Presque tous les patients
hospitalisés ont au moins
un facteur de risque pour
la TEV
•40 % ont 3 facteurs de
risque ou plus
•Jusqu’à 50 % des cas de
TEV ne présentent aucun
facteur de risque connu
•Chirurgie
•Trauma ( trauma majeur ou blessure membres inférieurs)
•Immobilité, parésie membres inférieurs
•Cancer (phase active ou occulte)
•Traitement du cancer (hormonal, chimiothérapie, inhibiteurs de
l’angiogenèse, radiothérapie)
•Compression veineuse (tumeur, hématome, anormalité artérielle)
•TEV antérieure
•Âge plus avancé
•Grossesse et période post-partum
•Contraceptifs oraux contenant des oestrogènes ou
hormonothérapie
•Modulateurs sélectifs des récepteurs oestrogéniques (SERM)
•Produits stimulant l'érythropoïèse
•Maladie mentale aiguë
•Maladie intestinale inflammatoire
•Syndrome néphrotique
•Troubles myéloprolifératifs
•Hémoglobinurie paroxystique nocturne
•Obésité
•Cathéter veineux central
•Thrombophilie héréditaire ou acquise
Geerts WH, American College of Chest Physicians, et al., CHEST 2008; 133:381S-453S.
Naess JA, et al., J Thromb Haemost. 2007;5:692-699.
Incidence à long terme de cancer occulte
•Étude cas-témoins
•1 495 patients avec TEV symptomatique
•55 % non provoquées
•Suivi de 30 mois, six mois après la TEV
Prandoni P. J Thromb Haemost. 2010;8(5):1126-7.
Incidence cumulative du cancer :
- - - - TEV : 3,2 % (IC 95 % : 2,3-4,4)
Témoins : 2,9 % (IC 95 % : 2,0-4,0)

2017-01-26
5
Considérations pour le dépistage du cancer
occulte chez les patients avec TEV
Détection précoce
•Cancer guérissable
• ↑ survie
• ↓ morbidité
Traitement avec HFPM
• ↓ taux récidive TEV
• ↑ survie chez patients
sans maladie
métastatique
Anxiété
Peut entraîner
procédures invasives
inutiles
•« découvertes
incidentelles »
Coûts
POURQUOI?
POURQUOI PAS?
Carrier M. ICTHIC 2016. PL-01.
Stratégies de dépistage du cancer
Limitées
•Antécédents
•Examen physique
•Analyses sanguines de base
•CXR
•Dépistage approprié âge/sexe
Approfondies
•Comme ci-dessus, en association avec :
•Scanographie (CAT scan) abdomen/pelvis
•Échogramme abdomen/pelvis
•Marqueurs de tumeurs (PSA, CEA, CA-125)
•Tomographie par émission de positons (PET scan)
Carrier M. ICTHIC 2016. PL-01.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
1
/
55
100%