la sphere orl

-
-
G
Gé
én
né
ér
ra
al
li
it
té
és
s
-
-
- 3 -
I
I
-
-
L
LA
A
S
SP
PH
HE
ER
RE
E
O
OR
RL
L
:
:
I.1. Définition et description anatomique
I.1.1. Définition
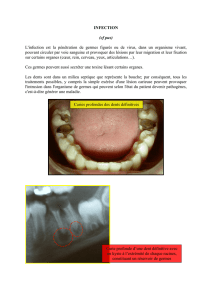
L’ORL ou oto-rhino-laryngologie est une spécialité médicale et
chirurgicale étudiant la physiologie des oreilles, du nez et de la gorge (larynx et
pharynx), la pathologie et le traitement des maladies d’une région anatomique
comprise entre la base du crâne et l’orifice supérieur du thorax, excepté les dents
et les yeux [51].
I.1.2. Description anatomique [44]
I
I.
.1
1.
.2
2.
.1
1.
.
L
L’
’o
or
re
ei
il
ll
le
e
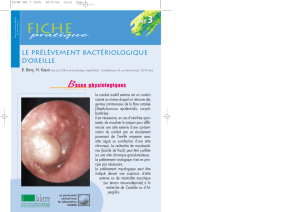
L’oreille est un organe neurosensoriel à double fonction : il assure
l’audition et joue un rôle très important dans l’équilibre. Cet organe comprend
plusieurs parties : l’oreille externe, l’oreille moyenne et l’oreille interne.
Figure 1 : Coupe verticale de l’oreille [6]

-
-
G
Gé
én
né
ér
ra
al
li
it
té
és
s
-
-
- 4 -
I.1.2.1.1. L’oreille externe
Elle est constituée par le pavillon et le conduit auditif externe (CAE).
L’oreille externe collecte les sons. Le CAE peut être assimilé à un diverticule
cutané étendu de la conque à la membrane tympanique qu’il tapisse.
I.1.2.1.2. L’oreille moyenne
Elle comprend un ensemble de cavités aériennes centré sur la caisse du
tympan (ou tympanum), prolongé vers l’avant par le protympanum et la trompe
d’Eustache, et vers l’arrière par les cellules mastoïdiennes. La membrane
tympanique sépare la caisse et le CAE.
I.1.2.1.3. L’oreille interne
Elle contient les organes neurosensoriels pour les deux grands fonctions :
Le canal cochléaire pour l’audition et les macules de l’utricule et du saccule
ainsi que les cupules des canaux semi-circulaires. L’ensemble constitue le
vestibule destiné à l’équilibre.
I
I.
.1
1.
.2
2.
.2
2.
.
L
Le
es
s
f
fo
os
ss
se
es
s
n
na
as
sa
al
le
es
s,
,
l
le
es
s
s
si
in
nu
us
s
e
et
t
l
le
e
c
ca
av
vu
um
m
Ceux-ci constituent une unité anatomique qui représente la partie purement
aérienne des voies aéro-digestives supérieures. L’infection de l’un de ces
éléments risque de retentir sur les autres parties de cet ensemble.

-
-
G
Gé
én
né
ér
ra
al
li
it
té
és
s
-
-
- 5 -
Figure 2 :Coupe verticale de la paroi externe de la fosse nasale droite[64]
Figure 3 : Coupe de la région nasale de la face [64]

-
-
G
Gé
én
né
ér
ra
al
li
it
té
és
s
-
-
- 6 -
I.1.2.2.1. Les fosses nasales
Elles forment deux cavités situées au milieu du massif facial supérieur,
sous la partie médiane de l’étage antérieur de la base du crâne, séparées par une
cloison sagittale, et protégées en avant par un auvent appelé pyramide nasale.
Leur paroi latérale joue un rôle considérable dans la physiologie respiratoire
grâce aux cornets qui augmentent considérablement la surface muqueuse et
protègent les méats. Dans le méat moyen débouchent les sinus antérieurs, et
dans le méat inférieur le canal lacrymal.
La muqueuse nasale a une fonction olfactive et respiratoire.
I.1.2.2.2. Les sinus de la face
Ils constituent un ensemble de cavités pneumatiques dérivées des fosses
nasales, creusées à la périphérie des cavités orbitaires.
Il y a quatre types de sinus :
Le sinus maxillaire : l’ostium se situe à la partie supéro-médiale de
la cavité sinusienne, expliquant son éventuel mauvais drainage.
Les cellules ethmoïdales : elles sont situées entre la partie haute des
fosses nasales et l’orbite.
Le sinus sphénoïdal : il est situé en haut et en arrière des fosses
nasales, sous l’étage moyen de la base du crâne.
Le sinus frontal : Le développement varie beaucoup d’un sujet à
l’autre et chez un même sujet d’un côté à l’autre. L’agénésie n’est
pas exceptionnelle.

-
-
G
Gé
én
né
ér
ra
al
li
it
té
és
s
-
-
- 7 -
I
I.
.1
1.
.2
2.
.3
3.
.
L
Le
e
p
ph
ha
ar
ry
yn
nx
x,
,
l
le
e
l
la
ar
ry
yn
nx
x
e
et
t
l
le
e
v
vo
oi
il
le
e
d
du
u
p
pa
al
la
ai
is
s
Figure 4 : Coupe verticale de la tête [43]
I.1.2.3.1. Le pharynx
C’est un conduit musculo-membraneux, disposé verticalement en avant de
la colonne cervicale, derrière la face, étendu de la base du crâne à la partie
supérieure du cou. Il constitue un large vestibule où se croisent la voie
respiratoire et la voie digestive.
La partie supérieure du pharynx constitue le cavum nasopharyngien ou
rhinopharynx. L’oropharynx, centre du carrefour aéro-digestif, correspond à la
partie postérieure de la cavité buccale et comprend, de chaque côté, la loge de
l’amygdale palatine, entre les deux piliers du voile. L’hypopharynx, situé devant
les 5
ème
et 6
ème
vertèbres cervicales, au-dessous de l’oropharynx, est séparé de lui
par un plan fictif passant par l’os hyoïde. C’est une région essentiellement
digestive mais dont l’atteinte peut engendrer des troubles respiratoires.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
1
/
26
100%