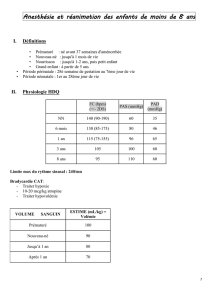
quel anesthesique local pour les blocs peripheriques chez l`adulte

Anesthésie locorégionale 117
QUEL ANESTHESIQUE LOCAL POUR LES BLOCS
PERIPHERIQUES CHEZ L’ADULTE?
H. Bouaziz, Service d’Anesthésie-Réanimation, Hôpital Central, 54035 Nancy cedex.
1. MELANGES
En pratique clinique, les anesthésiques locaux de longue durée d’action sont fré-
quemment associés à des anesthésiques locaux de durée courte à intermédiaire, l’idée
étant d’obtenir un délai d’action qui soit le plus court possible, tout en bénéficiant
d’une longue durée d’action. De plus, l’autre avantage avancé par les partisans de l’uti-
lisation de telles associations est la réduction de toxicité en comparaison à celle observée
avec l’utilisation de chaque agent utilisé seul.
1.1. TO XICITE
D’un point de vue toxicité, les effets de chacun des anesthésiques locaux associés
sont pour la plupart des études animales consacrées à ce sujet, de type additif [1-4].
Seuls deux travaux font état d’effets toxiques synergiques [5] ou au contraire antago-
nistes [6] avec l’utilisation d’associations d’anesthésiques locaux. Ces études ont utilisé
la dose convulsivante, la dose létale ou le délai avant arrêt cardio-respiratoire comme
paramètres de mesure de la toxicité de mélanges anesthésiques différents, chez des
espèces animales différentes. Une étude s’est plus spécifiquement intéressée aux effets
cardiovasculaires du mélange lidocaïne/bupivacaïne chez des cochonnets [7].
Les résultats de cette étude sont d’interprétation difficile avec une moindre incidence
d’arythmies avec le mélange par rapport à l’utilisation de la bupivacaïne seule alors que
la quantité de bupivacaïne nécessaire à la survenue d’arythmies, de convulsions, d’EEG
isoélectriques et d’asystolies était moins importante dans le groupe d’animaux recevant
le mélange. D’autre part lorsque les arythmies étaient observées dans ce groupe, leur
nature et leur intensité étaient identiques à celles du groupe bupivacaïne. Utilisant le
même modèle animal, Lalourcey et coll. montrent que les intervalles PQ, QRS et HV
sont significativement plus allongés avec la bupivacaïne seule qu’avec le mélange bupi-
vacaïne/lidocaïne ou avec la lidocaïne seule [8]. En revanche, Simon et coll. sur un
modèle de cœur isolé de lapin, montrent que l’adjonction de lidocaïne à la bupivacaïne
tend à allonger la durée du QRS [9].
Chez l’homme, alors que Moore et coll. à partir d’un collectif de 986 blocs périphé-
riques associant de la mépivacaïne et de la tétracaïne ne retrouvent aucune complication,
Brown et coll. ont montré que la survenue d’une toxicité systémique était plus fréquente
avec l’association bupivacaïne/2-chloroprocaïne qu’avec la bupivacaïne seule

MAPAR 2001118
(8,42/1000 versus 2,53/1000 ; p = 0,045) [10, 11]. L’inhibition de l’hydrolyse de la
2-chloroprocaïne par la bupivacaïne, pourrait, selon les auteurs de l’étude, expliquer
cette toxicité plus importante observée avec le mélange [12]. Ces deux études rétros-
pectives ont malheureusement une portée limitée du fait de la méthodologie utilisée et
du nombre limité de blocs périphériques. Seule une étude prospective de grande enver-
gure permettrait de connaître l’incidence de ce type de complication au décours de
blocs nerveux périphériques réalisés avec de la bupivacaïne seule ou associée à la
lidocaïne.
En d’autres termes, il est actuellement difficile de conclure à une moindre toxicité
des mélanges d’anesthésiques locaux par rapport aux agents pharmacologiques pris
isolément et en particulier à la bupivacaïne.
1.2. MEL ANGES ET P AR AMETRES D’INST ALLATION ET DE LEVEE D’UN
BLOC PERIPHERIQUE
L’administration intradermique de diverses solutions anesthésiques chez des volon-
taires semble montrer des résultats qui varient selon les associations utilisées. Ainsi, le
mélange lidocaïne-bupivacaïne produit une anesthésie dont la durée est similaire à
celle obtenue avec la bupivacaïne utilisée seule [13]. En revanche, l’association
chloroprocaïne-bupivacaïne produit une anesthésie dont la durée est très inférieure à
celle obtenue avec la bupivacaïne seule [14]. Ce résultat obtenu avec la chloroprocaïne
pourrait s’expliquer par une compétition entre les deux anesthésiques locaux pour leur
fixation à des récepteurs non spécifiques. Ainsi l’affinité de la chloroprocaïne pour ces
sites serait plus importante que celle qui caractérise la bupivacaïne expliquant la durée
d’action plus réduite du bloc en rapport avec l’association chloroprocaïne-bupivacaïne.
Il faut néanmoins noter que dans ce modèle d’injection intradermique, la solution anes-
thésique injectée est immédiatement accessible aux terminaisons nerveuses, ce qui
minimise son pouvoir de diffusion. Cette situation n’est pas celle qui est observée lors-
qu’une solution d’anesthésiques locaux est administrée par voie périnerveuse, situation
dans laquelle le pouvoir de diffusion de la solution (influencé par le pKa et le pH du
mélange) jouera un rôle important.
Les travaux consacrés aux associations d’anesthésiques locaux administrés par voie
périnerveuse sont rares. Deux d’entre eux ont été consacrés à l’association lidocaïne
carbonatée-bupivacaïne avec et sans adrénaline [15-16]. Les résultats publiés vont
d’ailleurs dans le même sens avec un délai d’action significativement plus court avec
l’association par rapport à la bupivacaïne utilisée seule alors que la durée d’action de
l’association est certes plus longue qu’avec la lidocaïne seule mais moins longue qu’avec
la bupivacaïne. Il est à noter qu’un travail a montré l’intérêt de l’association d’adrénaline
au mélange lidocaïne-bupivacaïne sur les taux plasmatiques de chacun des anesthésiques
locaux utilisés [17]. Dans la troisième étude, l’association chloroprocaïne-bupivacaïne a
été comparée à la bupivacaïne seule. Là encore, le délai avant obtention
d’une anesthésie
chirurgicale est plus court avec l’association alors que la durée du bloc sensitif est
identique entre les deux groupes [18]. Néanmoins l’effet de l’association chloro-
procaïne-bupivacaïne pourrait varier selon le pH de la solution finale comme l’a bien
démontré Galindo et coll. sur le nerf sciatique de rats [19].
Au total, là encore trop peu de travaux ont été consacrés à l’association lidocaïne-
bupivacaïne utilisée en France pour permettre de conclure à l’efficacité de cette asso-
ciation sur les paramètres d’installation et de levée du bloc. On peut néanmoins faire
l’hypothèse que le résultat d’une telle association va dépendre des paramètres pharma-
cologiques (diffusion, liaison aux protéines spécifiques ou non) qui varient selon le pH

Anesthésie locorégionale 119
de la solution finale. Sachant que le pH d’une solution d’anesthésiques locaux varie
d’un lot commercial à l’autre ou selon que de l’adrénaline est ou non associée. Il est
logique que le résultat final soit très variable.
2. ANESTHESIQUES LOCAUX DE LONGUE DUREE D’ACTIONANESTHESIQUES LOCAUX DE LONGUE DUREE D’ACTION
ANESTHESIQUES LOCAUX DE LONGUE DUREE D’ACTIONANESTHESIQUES LOCAUX DE LONGUE DUREE D’ACTION
ANESTHESIQUES LOCAUX DE LONGUE DUREE D’ACTION
2.1. ROPIV ACAINE / BUPIV ACAINE
La ropivacaïne est depuis peu disponible sur le marché Français. Ses propriétés
pharmacologiques en font un concurrent sérieux de la bupivacaïne en anesthésie loco-
régionale périphérique. D’un point de vue pharmacologique, la ropivacaïne se différencie
de la bupivacaïne par une liposolubilité moins importante et une demi-vie plus courte.
Par ailleurs il ne fait pas de doute aujourd’hui que la ropivacaïne est moins toxique que
la bupivacaïne. Cette moindre toxicité neurologique et cardiovasculaire a été montrée
in vitro mais également in vivo chez l’animal et chez l’homme [20-28]. Enfin, le bloc
moteur observé après administration de ropivacaïne pourrait être moins important que
celui observé avec la bupivacaïne [29]. Certaines études réalisées chez l’homme sem-
blent mettre en évidence le fait que, par voie périmédullaire la ropivacaïne serait moins
puissante que la bupivacaïne ce qui pourrait expliquer en partie les particularités phar-
macodynamiques de la ropivacaïne par rapport à la bupivacaïne [30].
Pour ce qui concerne les blocs tronculaires, une première étude a été faite chez des
volontaires chez lesquels des blocs du nerf ulnaire au coude ont été pratiqués [31]. La
durée des blocs sensitif, moteur et sympathique était proportionnelle à la dose de ropi-
vacaïne administrée. La ropivacaïne à 0,5 et à 0,75 % à procuré un bloc d’une durée
moyenne de 8 heures. L’adjonction d’adrénaline n’a eu aucun effet sur le délai ou la
durée du bloc obtenu. Par ailleurs aucune différence n’a pu être observée entre la ropi-
vacaïne 0,5 % et la bupivacaïne 0,25 % alors que la durée du bloc à la bupivacaïne
0,25 % adrénalinée avait une tendance a être plus importante que celle obtenue avec la
ropivacaïne 0,5 % sans que cette différence n’atteigne la signification au plan statisti-
que.
Concernant le bloc du plexus brachial, Hickey et Coll. après avoir montré que la
ropivacaïne à 0,25 % s’accompagnait d’un taux d’échecs trop important, ont comparé
la ropivacaïne et la bupivacaïne, les deux agents étant utilisés à la concentration de
0,5 %, sans adjonction d’adrénaline, l’administration se faisant par voie supraclavicu-
laire [32, 33]. Dans cette étude, aucune différence entre les deux produits n’a pu être
montrée qu’il s’agisse de la durée des blocs moteur et sensitif ou du délai d’action.
D’autre part, une fois encore il a été montré par la même équipe que l’adjonction d’adré-
naline n’apportait rien de plus sur ces mêmes paramètres ou sur les paramètres
pharmacocinétiques (Cmax, Tmax) [34]. Des résultats identiques ont été rapportés par
d’autres équipes concernant l’effet des deux anesthésiques locaux utilisés à 5mg.mL-1
sur les paramètres d’installation et de levée d’un bloc du plexus brachial [35, 36].
Ainsi, à doses équivalentes, la ropivacaïne semble aussi puissante que la bupivacaïne,
impression qui a d’ailleurs été confirmée récemment [37].
D’autres travaux ont comparé la ropivacaïne à 7,5 mg.mL-1 à la bupivacaïne à
5 mg.mL-1 [38-43]. Trois d’entre eux ne montrent aucune différence sur les paramètres
d’installation ou de levée du bloc [38-40], les trois autres montrant un délai d’installa-
tion d’une analgésie de type chirurgicale significativement plus court avec la ropivacaïne
0,75 % qu’avec la bupivacaïne 0,5% (41-43). Concernant la durée d’analgésie elle était
là encore comparable quel que soit l’anesthésique local même si la seule étude portant
sur un bloc des membres inférieurs a mis en évidence une durée de bloc avec la ropiva-
caïne à 0,75 % qui était intermédiaire entre celle retrouvée avec la mépivacaïne à 2% et

MAPAR 2001120
la bupivacaïne à 0,5 %. Il est à remarquer que la qualité méthodologique des études en
présence fait pencher la balance en faveur d’un délai d’action plus rapide de l’installa-
tion du bloc avec la ropivacaïne 0,75 %. En effet, deux des trois études ne mettant pas
de différence en évidence [39-40] étaient réalisées dans cinq centres différents qui dans
un cas n’utilisaient pas les mêmes techniques d’identification du plexus brachial [39].
D’autre part, le bloc était évalué toutes les 10 minutes ce qui n’est pas l’intervalle de
temps le mieux adapté à l’évaluation de l’installation de l’anesthésie. Enfin aucun effet
inter-centres n’ayant été recherché, celui-ci ne peut être éliminé. Quant au travail de
Klein et coll. le délai moyen d’installation de l’anesthésie était trop bref dans le deux
groupes (inférieur à 6 minutes !) pour qu’une différence ait pu être mise en éviden-
ce [38]. Le délai d’action de la ropivacaïne est dose dépendant [44, 45]. La
ropivacaïne 0,75 % disponible en France a aussi un délai d’action similaire à celui re-
trouvé avec la mépivacaïne 2 % [42, 44, 45].
2.2. LEVOBUPIV ACAINE / BUPIV ACAINE
Chez l’homme, l’effet de la lévobupivacaïne a été comparé à celui de la bupi-
vacaïne après administration au décours d’un bloc du nerf ulnaire au coude réalisé chez
des volontaires [46]. La durée des blocs moteur et sensitif était similaire aux différentes
concentrations testées. Concernant les blocs des membres, on dispose d’une étude ayant
comparé les deux anesthésiques locaux après administration par voie supracla-
viculaire [47]. Qu’il s’agisse du délai de la durée d’action ou du taux de réussite,
aucune différence significative n’a pu être observée.
D’autres études sont nécessaires pour tirer des enseignements concernant la place
de cet anesthésique local en anesthésie locorégionale des membres.
En conclusion de cette première partie, il semble à la lecture des différents travaux
sus-cités que si l’objectif est d’obtenir une anesthésie locorégionale des membres
caractérisée par une moindre toxicité et un délai d’action plus rapide (par rapport à
l’utilisation de bupivacaïne seule), la ropivacaïne à 7,5 mg.mL-1 semble plus intéres-
sante que les associations d’anesthésiques locaux, cependant le risque de toxicité
neurologique est toujours possible à de telles concentrations.
3. ANESTHESIQUES LOCAUX DE DUREE D’ACTION COURTE A
INTERMEDIAIRE
3.1. LIDOC AINE / MEPIV ACAINE
Une des premières études comparant des anesthésiques locaux de durée d’action
courte ou intermédiarie et utilisant une méthodologie permettant l’interprétation des
résultats a été réalisée par Winnie et coll [48]. La mépivacaïne 1 % non adrénalinée
était comparée à la lidocaïne 1 % non adrénalinée et les eux agents étaient administrés
par voie sus-claviculaire. Cette étude a montré clairement que le délai d’installation du
bloc sensitif (qu’il s’agisse du stade d’analgésie ou du stade d’anesthésie) était signifi-
cativement plus court avec la lidocaïne qu’avec la mépivacaïne. En revanche aucune
différence n’était observée entre les deux anesthésiques locaux s’agissant du délai
d’installation du bloc moteur. La durée des blocs sensitif et moteur ainsi que l’intensité
du bloc moteur était plus importante avec la mépivacaïne qu’avec la lidocaïne. Cette
différence de durée d’action du bloc sensitif et moteur observée entre les deux anesthé-
siques locaux pourrait être liée à leur effet sur les vaisseaux. En effet, la mépivacaïne
aurait un effet vasodilatateur moins marqué que celui observé avec la lidocaïne, à doses
identiques.

Anesthésie locorégionale 121
La durée du bloc sensitif obtenu avec la mépivacaïne sans adrénaline et de la lido-
caïne adrénalinée administrées par voie axillaire est similaire [49]. Tout ce passe comme
si l’avantage observé avec la mépivacaïne sur la lidocaïne était effacé par l’adjonction
d’adrénaline à la lidocaïne. En revanche la durée du bloc moteur pourrait être plus
courte avec la mépivacaïne. Si cette dernière information était confirmée par des études
ultérieures, la mépivacaïne pourrait devenir l’anesthésique local de choix pour des chi
rur-
gies de courte durée réalisées sur le mode ambulatoire. En effet, la levée du bloc moteur
plus précoce pourrait permettre une sortie plus rapide de la structure ambulatoire
.
Si l’on s’intéresse ensuite à la comparaison entre ces mêmes agents pharmacologi-
ques, tous deux étant administrés sous une forme adrénalinée au niveau du plexus
brachial, on observe un délai d’action plus court pour la lidocaïne que pour la mépiva-
caïne [50]. En revanche la durée de l’analgésie ainsi que le pourcentage de patients
ayant un bloc moteur complet, ou encore l’absence totale de sensation au cours de
l’intervention ne sont pas différentes entre les deux groupes. Tout ce passe comme si,
contrairement à ce qui est observé avec la lidocaïne, l’adjonction d’adrénaline à la
mépivacaïne ne produisait qu’un effet très modeste sur les paramètres de durée du bloc
obtenu. Cette hypothèse est sous-tendue par l’effet vasodilatateur moins marqué de la
mépivacaïne par rapport à la lidocaïne mais également par des études qui ont montré
que l’adjonction d’adrénaline avait pour effet d’allonger la durée d’action de 200 %
avec la lidocaïne alors qu’elle n’est allongée que de 42 % avec la mépivacaïne [51].
Au total, à la lecture du peu d’articles consacrés à la comparaison de ces deux agents
pharmacologiques pour l’anesthésie locorégionale des membres, il ne ressort pas d’avan-
tage en faveur de la mépivacaïne par rapport à la lidocaïne adrénalinée en dehors peut-être
de la chirurgie de courte durée réalisée sur le mode ambulatoire.
4. ASSOCIATION DE TECHNIQUES/ANESTHESIES SELECTIVES
C’est à partir des connaissances anatomiques et/ou pharmacologiques que l’idée
d’associer des techniques ou d’injecter sélectivement une substance ayant des proprié-
tés pharmacologiques intéressantes a pu germer. Ainsi, associer une analgésie de longue
durée qui concerne préférentiellement le site chirurgical à un bloc moteur de courte
durée est possible dans certaines situations cliniques [52]. C’est le cas pour la chirurgie
palmaire de surface qui est pratiquée sur une région anatomique qui du point de vue
sensitif dépend quasi exclusivement des nerfs ulnaire et médian. Au niveau du canal
brachial, les nerfs sont suffisamment distants pour pouvoir être anesthésiés séparément
sans risque de diffusion d’un nerf à l’autre. L’injection d’anesthésiques locaux de lon-
gue durée d’action sur les nerfs médian et ulnaire et d’anesthésiques locaux de courte
durée sur les nerfs radial et musculocutané s’accompagne d’une analgésie de longue
durée sur la face palmaire. De plus, le bloc moteur se lève rapidement sur les groupes
musculaires dépendants des nerfs radial et musculocutané, ce qui permet au patient de
contrôler son membre supérieur avant son retour à domicile.
C’est parfois l’absence de bloc moteur au niveau du site chirurgical qui est recher-
chée [53]. Afin d’améliorer l’efficacité d’une ténolyse des tendons fléchisseurs il est
intéressant que le patient puisse sur demande mobiliser le ou les doigt(s) intéressé(s).
Sparks et Quinn rapportent le cas d’un patient devant bénéficier d’une ténolyse du
tendon fléchisseur du deuxième doigt pour lequel un bloc du nerf médian au poignet a
été pratiqué avec un anesthésique local de longue durée. Ce bloc distal en épargnant les
collatérales issues du nerf médian destinées à assurer l’innervation motrice de certains
groupes musculaires va permettre la mobilisation du doigt tout en assurant une anal-
gésie de la région intéressée par l’acte chirurgical. Néanmoins, la mise en place d’un
 6
6
 7
7
 8
8
1
/
8
100%