séparation des constituants d`un mélange organique

Exercices MathSpé PC 2012-2013
C. Saury Page 1 sur 6
Chapitre O8 :
Les composés carbonylés-partie 2
Exercice 1 :
On donne, dans le tableau ci-après, la valeur de la constante de l'équilibre cetone énol (à 25°C).
1. Quelle est la forme énol prépondérante de l'acétylacétone? Quels facteurs structuraux permettent
d'expliquer sa valeur de K très élevée par rapport à l'acétone?
2. Comment peut-on expliquer les valeurs très différentes de K observées pour la cyclohexanone, la
cyclohexane-1,2-dione, la cyclohexa-2,4-diénone et la camphoquinone?
Exercice 2 :
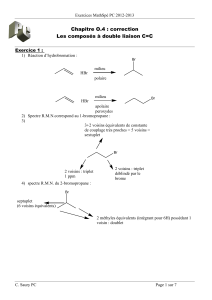
1) A - 78 °C, à 10 mmol de diisopropylamine dissous dans le THF, on ajoute 10mmol de
butyllithium. On forme ainsi le LDA. A cette base, on ajoute la cétone (9 mmol). Les résultats
sont les suivants :
O
Ph LDA
O
LDA
O
Ph
uniquement
O
uniquement
Interpréter ces résultats. Pourquoi l'énolate est-il appelé l'énolate cinétique ?

Exercices MathSpé PC 2012-2013
C. Saury Page 2 sur 6
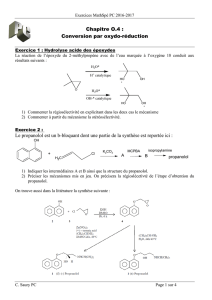
2)A 10 mmol de KH dans le THF, on ajoute à température ambiante 12 mmol de cétone. Les résultats
sont les suivants :
O
Ph
O
Ph
uniquement
KH
Interpréter ces résultats. Pourquoi l'énolate est-il appelé l'énolate thermodynamique ?
3)Les pourcentages relatifs des différents énolates sont obtenus par analyse du mélange obtenu par
réaction de l'anhydride acétique avec les énolates.
a/écrire la réaction sachant qu'il y a uniquement O-alkylation.
b/montrer que la RMN permet de déterminer les pourcentages relatifs.
Exercice 3 :
Donnez les produits des réactions suivantes :
H
O
+O
H
OH- 2 composés
H
O
OH-
A
O
OOH-B
O
C
1) LDA
2)1-bromopropane
O
O1) LDA
2) iodoéthane D
NO21)NaH
2)PhCH2IE
O O
F
1) OH-
2)1-bromopropane
Exercice 4 :
1) Donner le produit A de la réaction:
O O O
+pyridine A

Exercices MathSpé PC 2012-2013
C. Saury Page 3 sur 6
2) Donner les structures des intermédiaires B, C et du produit D.
butanal B C D
C8H14O
OH-OH-
chauffage
1) Et2CuLi
2) H2O
3) Donner les résultats des transformations suivantes sachant qu’on forme à la fin un nouveau cycle
au sein de la molécule
Exercice 5 :
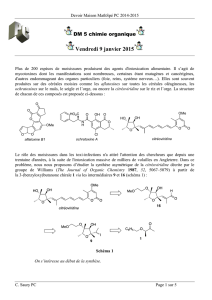
Lorsque le composé A est traité par une base on obtient trois produits isomères. Expliquer leur
formation.
O
Br KOH
O
13% 15%
6%
O
O
+
+
Exercice 6 : INA ENSA 1996
Le spirosantalol est un produit odorant extrait du bois de santal. Sa synthèse peut être faite à
partir de la norbornanone dont la formule est donnée ci-dessous :
Une partie de cette synthèse est proposée.
1) La norbornanone a la représentation perspective suivante :
O
a/Indiquer les atomes de carbones asymétriques de la norbornanone.
b/Déterminer leur configuration absolue. La molécule est-elle chirale ?
2)En milieu anhydre, la norbornanone est mise en présence d’amidure de sodium NaNH2.

Exercices MathSpé PC 2012-2013
C. Saury Page 4 sur 6
a/Montrer que deux sites de la norbornanone peuvent réagir avec l’amidure de sodium. Justifier la
réactivité particulière de ces deux sites.
b/L’évolution ultérieure montre qu’un seul des deux sites réagit. Préciser lequel en proposant une
justification.
c/Le produit obtenu par mise en présence de norbornanone et d’amidure de sodium réagit sur le 4-
bromo-2-méthylbut-1-ène. Donner une représentation de la structure du composé A obtenu et le
schéma de sa formation.
d/Préciser les réactifs et le type des réactions réalisées pour passer de A à B.
O
B
e/B est obtenu sous forme de stéréoisomères, préciser lesquels. Quelle(s) relation(s) de
stéréoisomérie y-a-t-il entre eux ?
3)L’ozonolyse de B, suivie d’un traitement réducteur, conduit au composé C . Représenter le
composé C.
4)Le composé C est traité en milieu basique. Des produits de formule brute C13H18O3 sont obtenus.
a/Déterminer les deux produits D1 et D2 obtenus de façon préférentielle en justifiant.
b/Donner le mécanisme de la formation de l’un d’eux à partir de C en supposant que la base est l’ion
hydroxyde.
c/L’expérience montre, comme pour d’autres cas semblables, que l’un des composés, D1, est plus
abondant que l’autre. Préciser lequel.
5)Un chauffage en milieu acide provoque la déshydratation de D1 en E.
a/Donner une représentation de E, produit très majoritaire. Expliquer la régiosélectivité de cette
réaction et son mécanisme.
b/Par hydrogénation catalytique à pression ordinaire, E est transformé en F. Donner la représentation
de la structure de F. Proposer un catalyseur adapté à cette hydrogénation.
Exercice 7 : Olympiades internationales de chimie 2005
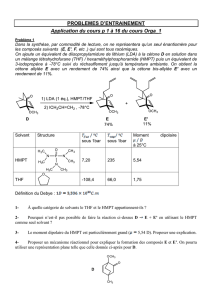
Les différentes étapes de l’élaboration de l’arénarane A à partir du composé 1 vont être
passées en revue.
O
1
Première étape
O O
OEt
1
O
OEtEtO
1) NaH ,
2) H2O / H+
13
SnCl4
O
COOEt
10

Exercices MathSpé PC 2012-2013
C. Saury Page 5 sur 6
Le composé 1, en solution dans le THF, est ajouté goutte à goutte à une solution de carbonate
de diéthyle 9 contenant une quantité stœchiométrique d’hydrure de sodium NaH. Le milieu est
ensuite chauffé à reflux du solvant. Après hydrolyse acide modérée le composé 10 est isolé.
1. Sachant que l’hydrure de sodium est une base très forte non nucléophile, quelle est la structure
du premier composé intermédiaire qui peut se former dans le milieu ?
2. Sous quelle forme est présent le composé 10 avant l’hydrolyse ? Justifier la réponse.
Deuxième étape
Il s’agit de la cyclisation de 10 en 13, sous l’action du tétrachlorure d’étain, acide de Lewis. Un
mécanisme schématique est proposé.
3. Rappeler la définition d’un acide de Lewis.
4. Écrire deux structures de Lewis pour l’intermédiaire résultant de la fixation du tétrachlorure
d’étain sur le groupe carbonyle cétonique. Quelle est celle qui a vraisemblablement le plus
grand poids dans la structure réelle ?
5. Ce cation perd un ion hydrogène et il se forme du chlorure d’hydrogène et un énolate d’étain 11
le plus stable possible. Représenter les transferts électroniques intramoléculaires
correspondants.
6. L’intermédiaire 11 se protone sous l’action du chlorure d’hydrogène. Écrire la structure du
cation 12 le plus stable conduisant à la possibilité de cyclisation en 13.
7. Le cation 12 se cyclise pour donner le composé 13 et le catalyseur est régénéré. Schématiser le
transfert d’électrons conduisant à la formation de 13.
Troisième étape
1) LiAlH4 , Et2O
2) H2O / NH4+
16
OH
OH
TsCl, py
OH
OTs
CrO3 , H2SO4
H2O
OTs
O
13
14
15
8. Donner une formule de Lewis (
Al 13Z
) et indiquer la structure géométrique de l’ion
4
AlH
.
Expliquer pourquoi cette espèce est l’équivalent chimique d’un ion hydrure.
9. Le groupe COOEt est réduit par l’hydrure choisi. Donner la formule de 14.
10. Le chlorure de tosyle (TsCl) est représenté ci-contre. Par
analogie avec la réaction d’acylation d’un alcool, proposer un
mécanisme pour la transformation de 14 en 15. Indiquer aussi
avec précision le rôle de la pyridine.
11. Le protocole proposé oblige à réoxyder le groupe hydroxyle
secondaire en groupe carbonyle. Proposer une méthode pour cette oxydation.
TsCl = Cl
O
S
O
 6
6
1
/
6
100%