unité de quantité de matière. 1) Une grosse, une myriade ou une mole

PAGE 1 SUR 3
CHAPITRE 12 : « COMMENT EXPRIMER UNE QUANTITE DE MATIERE PRESENTE DANS UN ECHANTILLON ? »
I) La mole : unité de quantité de matière.
1) Une grosse, une myriade ou une mole ?
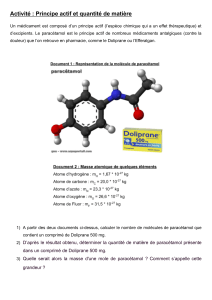
Activité.
2) Définition et constante d’Avogadro.
Une mole d’entités élémentaires (atomes ou ions ou molécules) est la quantité de matière d’un système contenant 6,02.1023
entités élémentaires.
La quantité de matière est la grandeur utilisée en chimie pour indiquer un nombre d’entités élémentaires.
La mole, de symbole mol, est l’unité de quantité de matière utilisée en chimie car c’est une unité bien adaptée.
Ce nombre de 6,02.1023 s’appelle la constante d’Avogadro notée NA.
NA s’exprime en mol1 car cette constante indique le nombre d’entités élémentaires par mole.
Exemples : Dans une mole d’eau H2O, il y a 6,02.1023 molécules d’eau ;
Dans une mole d’atomes de cuivre Cu, il y a 6,02.1023 atomes de cuivre ;
Dans une mole d’ion chlorure Cℓ, il y a 6,02.1023 ions chlorure.
3) Relation générale entre la quantité de matière et le nombre d’entités élémentaires.
Relation :
Quantité de matière (en mol)
Nombre d’entités élémentaires
1
NA = 6,02.1023
n
N
D’où
A
N
N
n
ou
A
n.NN
+ unités + signification de n et N.
Remarque : Cette relation est totalement indépendante de la nature de l’espèce chimique.
Exemples : Combien y a-t-il de molécules de CO2 dans 0,65 mol de CO2 ? 3,91.1023 molécules
Quelle est la quantité de matière contenue dans 1022 atomes de zinc ? 1,66.102 mol
II) Quantité de matière, masse et volume.
1) Masse molaire atomique.
La masse molaire atomique notée M d’un élément est la masse d’une mole d’atomes de cet élément. Elle s’exprime en gramme
par mole (g.mol1).
Les valeurs des masses molaires atomiques figurent dans la classification périodique des éléments.
Exemple : On lit : M(Cu) = 63,5 g.mol1 une mole d’atomes de cuivre, soit 6,02.1023 atomes de cuivre, a une masse de 63,5 g.

PAGE 2 SUR 3
2) Masse molaire moléculaire.
La masse molaire moléculaire notée M est la masse d’une mole de molécules.
Elle est égale à la somme des masses molaires atomiques de tous les atomes présents dans la molécule et s’exprime en g.mol1.
Exemples : M(H2O) = 2 M(H) + M(O) = 18 g.mol1 une mole de molécules d’eau, soit 6,02.1023 molécules d’eau, a une
masse de 18 g ;
M(NH3) = M(N) + 3 M(H) = 17 g.mol1 ;
M(CuSO4) = M(Cu) + M(S) + 4 M(O) = 159,6 g.mol1.
3) Masse molaire ionique.
La masse molaire ionique notée M est la masse d’une mole d’ions et s’exprime en g.mol1.
La masse des électrons étant négligeable devant celle de l’atome, la masse molaire ionique d’un ion monoatomique est égale à la
masse molaire atomique de l’élément correspondant. La masse molaire d’un ion polyatomique est égale à la somme des masses
molaires atomiques des atomes présents dans l’ion.
Exemples : M(Cℓ) M(Cℓ) = 35,5 g.mol1 ;
M(SO42) M(S) + 4 M(O) = 96,1 g.mol1.
4) Relation générale entre la quantité de matière et la masse.
Relation :
Quantité de matière (en mol)
Masse
1
M
n
m
D’où
M
m
n
ou
n.Mm
+ unités + signification de n, m et M.
Remarque : Cette relation est totalement dépendante de la nature de l’espèce chimique via la valeur de sa masse molaire.
Exemples : Quelle est la quantité de matière contenue dans 1 kg d’eau ? 55,5 mol
Quelle est la masse de 0,215 mol de dioxygène O2 ? 6,88 g
Combien y a-t-il de molécules d’eau dans 10 g d’eau ? 3,34.1023 molécules
Quelle est la masse d’une molécule d’eau ? 3.1023 g
5) Le cas des liquides.
a) Problématique.
Pour prélever une quantité de matière n d’une espèce chimique liquide, on peut, comme pour les solides, procéder par pesée de
la masse m correspondant à cette quantité.
Cependant on peut aussi mesurer le volume V qu’occupe la quantité de matière n si l’on connait la grandeur qui lie la masse et le
volume de l’espèce chimique considérée. Cette grandeur est la masse volumique.

PAGE 3 SUR 3
b) Masse volumique.
A une température et une pression données, la masse volumique ρ d’une espèce chimique est égale au quotient de sa masse m
par son volume V qu’elle occupe.
Relation :
V
m
ρ
ou
ρ.Vm
ou
ρ
m
V
+ unités.
c) Densité.
La densité d d’une espèce chimique par rapport à l’eau est égale au quotient de sa masse volumique ρ par celle de l’eau ρeau, ces
masses volumiques étant prises à la même température et la même pression.
Relation :
eau
ρ
ρ
d
ou
eau
d.ρρ
+ unités.
Remarques : On dit que l’eau constitue l’espèce chimique de référence ;
On prendra le plus souvent ρeau = 1000 g.L1.
d) Relation générale entre la quantité de matière et le volume.
Relation déduite :
M
Vdρ
M
ρV
M
m
neau
ou
eau
dρ
nM
ρ
nM
ρ
m
V
+ unités.
6) Diagramme synoptique.
Document.
1
/
3
100%