Télécharger - Oncauvergne

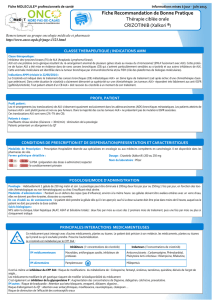
AcSé Crizotinib
ARC : Virginie Sabatier - 8431/5333
Critères d’inclusion
Accès sécurisé au Crizotinib pour les patients
souffrants d’une tumeur porteuse d’une altération
génomique sur des cibles biologique de la molécule
Homme ou femme âgé de plus de 1 an et Espérance de vie ≥3 mois
Cancer localement avancé inopérable ou métastatique
Au moins une altération spécifique identifiée parmi les gènes ALK, MET,
RON et ROS1 déterminée au niveau de la lésion primitive et/ou d’un site
métastatique
lésion cible d’au moins 20 mm (ou 10 mm avec un CT scanner spiralé) et la
présence d’au moins une lésion mesurable selon RECIST en dehors d’un
champ précédemment irradié ou d’un champ potentiel d’irradiation palliative
Fonction hématologique, rénale, hépatique satisfaisante
Patients capables de prendre les médicaments par voie orale
Indice de performance ECOG 0-2, ou Karnofsky > 50 %, Lansky Play Scale (<
12 ans) > 50%.
Les patients susceptibles de procréer, doivent accepter d’utiliser un moyen de
contraception efficace, pratiquer des méthodes adéquates de contrôle des
naissances, ou pratiquer l’abstinence complète pendant toute la durée du
traitement, 2 semaines avant la 1ère prise du médicament expérimental et
pendant au moins 3 mois après la dernière dose du traitement à l’étude.
AcSé Crizotinib
ARC : Virginie Sabatier - 8431/5333
Critères d’inclusion
Homme ou femme âgé de plus de 1 an et Espérance de vie ≥3 mois
Cancer localement avancé inopérable ou métastatique
Au moins une altération spécifique identifiée parmi les gènes ALK, MET,
RON et ROS1 déterminée au niveau de la lésion primitive et/ou d’un site
métastatique
lésion cible d’au moins 20 mm (ou 10 mm avec un CT scanner spiralé) et la
présence d’au moins une lésion mesurable selon RECIST en dehors d’un
champ précédemment irradié ou d’un champ potentiel d’irradiation palliative
Fonction hématologique, rénale, hépatique satisfaisante
Patients capables de prendre les médicaments par voie orale
Indice de performance ECOG 0-2, ou Karnofsky > 50 %, Lansky Play Scale (<
12 ans) > 50%.
Les patients susceptibles de procréer, doivent accepter d’utiliser un moyen de
contraception efficace, pratiquer des méthodes adéquates de contrôle des
naissances, ou pratiquer l’abstinence complète pendant toute la durée du
traitement, 2 semaines avant la 1ère prise du médicament expérimental et
pendant au moins 3 mois après la dernière dose du traitement à l’étude.
Accès sécurisé au Crizotinib pour les patients
souffrants d’une tumeur porteuse d’une altération
génomique sur des cibles biologique de la molécule

Les femmes non stériles en âge de procréer doivent avoir un test de grossesse
sérique négatif dans les 14 jours précédant l’inclusion et/ou un test de
grossesse urinaire 72 heures avant l’administration du traitement à l’étude.
Les femmes allaitantes doivent arrêter l’allaitement avant la 1ère
administration du produit à l’étude et jusqu’à 3 mois après la dernière dose.
Affiliation à un régime de sécurité social.
Note d’information et consentement éclairé signé par le patient. Pour un
patient âgé de moins de 18 ans, le patient et les parents sont informés et le
consentement éclairé est signé par les 2 parents.
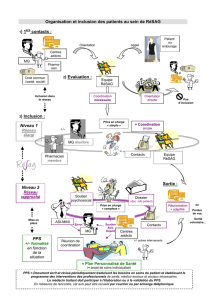
Cancer du poumon non à petites cellules avec translocation ALK/patients
porteurs maladie SNC (primitive ou secondaire)
Patiente éligible pour un essai clinique ouvert au recrutement en France
avec un
Traitement anticancéreux ciblant la même altération moléculaire
Patient déjà traité par Crizotinib
Pas de chirurgie majeure dans les 4 semaines/mineure 2 semaines avant le
début du traitement
Patients avec autres maladies graves/et ou non contrôlées : problème cardiaque,
Qtc> 470 msec et pas de traitements avec des médicaments reconnus
comme étant de forts inhibiteurs/inducteurs de l’isoenzyme CYP3A4
Critères de Non Inclusion
Les femmes non stériles en âge de procréer doivent avoir un test de grossesse
sérique négatif dans les 14 jours précédant l’inclusion et/ou un test de
grossesse urinaire 72 heures avant l’administration du traitement à l’étude.
Les femmes allaitantes doivent arrêter l’allaitement avant la 1ère
administration du produit à l’étude et jusqu’à 3 mois après la dernière dose.
Affiliation à un régime de sécurité social.
Note d’information et consentement éclairé signé par le patient. Pour un
patient âgé de moins de 18 ans, le patient et les parents sont informés et le
consentement éclairé est signé par les 2 parents.
Cancer du poumon non à petites cellules avec translocation ALK/patients
porteurs maladie SNC (primitive ou secondaire)
Patiente éligible pour un essai clinique ouvert au recrutement en France
avec un
Traitement anticancéreux ciblant la même altération moléculaire
Patient déjà traité par Crizotinib
Pas de chirurgie majeure dans les 4 semaines/mineure 2 semaines avant le
début du traitement
Patients avec autres maladies graves/et ou non contrôlées : problème cardiaque,
Qtc> 470 msec et pas de traitements avec des médicaments reconnus
comme étant de forts inhibiteurs/inducteurs de l’isoenzyme CYP3A4
Critères de Non Inclusion
1
/
2
100%