e2 12-13

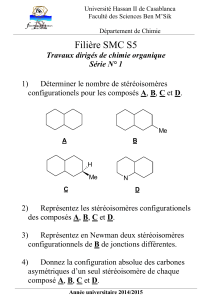
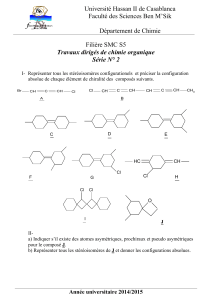
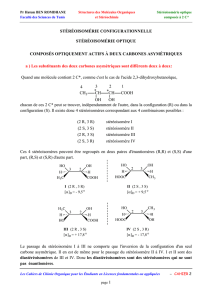
1
Examen de Chimie
Nom : Examen-2- Mars 2013
Numéro : Classes TSV, TSM
Durée : 105 min.
L’usage de la calculatrice programmable est autorisé
Cette épreuve comporte trois exercices de chimie présentés sur 6 pages numérotées de 1 à 6, y compris
celle-ci.
L’élève doit traiter les trois exercices qui sont indépendants les uns des autres.

2
Odeurs, arômes, parfums
Analyses spectrales
Les documents (1) et (2) donnent respectivement des extraits des spectres infrarouge des composés A et
B. Le spectre du composé A a été obtenu à partir d’une solution diluée de A dans le solvant
tétrachlorométhane CCℓ4 alors que celui du composé B l’a été à partir d’un film (couche fine) de B pur
à l’état liquide.
Les documents (3) et (4) donnent les spectres de RMN des composés A et B.
Le 4-éthylphénol A contribue à donner à certains
vins une odeur désagréable de sueur ou de cuir,
détectable dès que sa teneur dépasse 500 μg.L-1.
Le 2-phényléthanol B
est naturellement présent
dans les essences de rose, de géranium et dans
certains vins blancs. Le phényléthanal C a été mis
en évidence dans les céréales, dans le chocolat et
dans diverses fleurs. Des insectes l’utilisent pour
communiquer.
L’acide phényléthanoïque D est un solide qui
présente une odeur florale et sucrée; l’un de ses
dérivés le phényléthanoate d’éthyle E participle à
l’arôme du miel.
Bien que présents dans de nombreuses substances
naturelles,ces composés sont synthétisés
industriellement.
Exercice 1 : Identification spectrale de molécules organiques ( 11½ pts)
Doc.3
Doc.4

3
Questions
1. a. Déterminer les formules brutes de A et B. Conclure.
1. b. Justifier pourquoi, contrairement à A, le composé B est un alcool.
1. c. Identifier les groupes caractéristiques et les fonctions des composés C, D et E.
2. a. À l’aide du tableau 1 ci-après, attribuer les bandes d’absorption a, b, c, d, g, h, I et j, aux liaisons
présentes dans les molécules de A et B.
2. b. Les nombres d’onde et la forme des signaux a et g sont différents. Expliquer pourquoi.
3. La dégustation d’un vin blanc conduit à envisager la présence de traces des composés A et B.
3. a. Quelles sont les bandes d’absorption caractéristiques des constituants majoritaires du vin?.
3.b. Indiquer alors, pour quelle raison le spectre infrarouge de ce vin ne permettrait pas de vérifier la
présence des composés A et B dans le vin.
Donnée: Le vin est un mélange constitué principalement d’eau et d’éthanol.
4. a. À partir de l’analyse des multiplicités des signaux, attribuer les spectres de RMN des documents 3
et 4 aux composés A et B.
4.b. Représenter la formule semi-développée de B.
5. On réalise l’oxydation ménagée du composé B à l’aide d’un oxydant introduit en excès.
5. a.Quel produit obtient-on alors principalement?.
5. b. Justifier que le tracé d’un spectre de RMN du produit obtenu est alors une technique plus
appropriée pour vérifier sa pureté .
6. Ecrire l’équation de la réaction conduisant à E à partir de D et de l’éthanol. Citer les principales
caractéristiques de cette réaction.
Tableau 1 : bandes d’absorption de quelques liaisons en infrarouge
Liaison
Nombre d’onde
(cm
-1
)
Intensité
O- H libre
3580 - 3650
Forte; fine
O- H lié
3200 - 3400
F ; large
Ctri – H
3000 - 3100
M
Ctri – Haromat.
3030- 3080
M
Ctétra- H
2800 - 3000
F
Liaison
Nombre d’onde
(cm
-1
)
Intensité
C = O (ester)
1700 -1740
F
C = O(aldéh., cétone)
1650 -1730
F
C = O (acide)
1680 -1710
F
C = C (aromatique)
1450 - 1600
M
Ctétra- H
1415 - 1470
F

4
Tableau 2 : déplacement chimique δ(ppm) de quelques protons ( Ar désigne un composé aromatique
comme le benzène ou ses dérivés. R désigne un radical alkyle et CO correspond au groupe carbonyle).
Proton
δ(ppm)
Proton
δ(ppm)
Proton
δ(ppm)
CH3 -C
0,9
Ar - H
7 -9
C – CH2 – O- CO
4,1
CH3 –C - O
1,4
- CO -OH
8,5 – 13
C – CH2 – CO- O
2,2
CH3 –C – O - CO
1,3
R – OH
0,5 – 5,5
C – CH2 – Ar
2,7
R – CO - H
9,9
Ar - OH
4,2 – 7,1
C – CH2 – C
1,3
C – CH - Ar
3,0
C – CH2 – O- H
3,6
C – CH2 – Ccycle
1,5
Exercice 2 : Conformation et configuration ( 5 pts)
Document 1: Stéréoisomères de l’acide tartrique
L’acide tartrique est un acide naturel, qui présente 2 atomes de carbone asymétriques. Les groupes d’atomes
liés à chaque atome de carbone asymétrique étant identiques, on dénombre uniquement 3 stéréoisomères de
configuration pour l’acide tartrique. Deux des stéréoisomères forment un couple d’énantiomères, tandis que le
troisième stéréoisomère n’est pas chiral.
(a) (b) (c)
En 1848, Louis Pasteur montre que l’acide tartrique provenant des grains de raisin est composé de
deux énantiomères de l’acide tartrique en quantité égale: il s’agit d’un mélange racémique.
Document 2: une molécule présente dans le vin : Le butane-2,3- diol est un composé organique
présent dans le vin. Il se forme lors de la fermentation du glucose.
Quelques conformations du butane-2,3- diol :

5
Questions
1. Reproduire la formule du stéréoisomère (a) du document (1) et identifier les 2 atomes de carbone
asymétriques par un astérisque.
2.Identifier le stéréoisomère achiral,ainsi que les deux stéréoisomères formant le couple d’énantiomères.
3. Les stéréoisomères (a) et (c) sont-ils énantiomères ou diastéréoisomères?
Même question pour (b)et (c) . Justifier.
4. a. Identifier les conformations décalées et éclipsées de la molécule de butane-2,3- diol du document 2
b. Laquelle parmi ces 3 conformations est la moins stable et laquelle est la plus stable? Justifier.
En examinant la nature des produits et réactifs, identifier la catégorie de chacune des 7 réactions
ci-dessous ( substitution, addition ou élimination) en donnant une brève justification:
(1)
I-
+
CH3Cl Cl-
+
CH3I
+
CH3
C
C
H3
C
CH3
H
Br Br CH3C
CH3
Br
C
CH3
Br
H
(2)
+O
H
H
OH
(3)
Document 3 : Liaison hydrogène intramoléculaire
La liaison hydrogène est une interaction électrostatique, toujours attractive. Lorsqu’une molécule comporte des
groupes - OH et / ou – COOH suffisamment proches dans l’espace, une liaison hydrogène intramoléculaire est
susceptible de se former. Elle s’établit entre un atome d’hydrogène lié à un atome d’oxygène et un autre atome
d’oxygène qui porte un doublet non liant.
Exercice 3 : Catégories de transformation chimique ( 3½ pts)
 6
6
1
/
6
100%