UNIVERSITÉ PARIS XII-VAL DE MARNE Numéro d

Page 1 sur 6
UNIVERSITÉ PARIS XII-VAL DE MARNE Numéro d'anonymat………………………………
FACULTÉ DES SCIENCES ET TECHNOLOGIE DS du 10 avril 2009
LES CALCULATRICES NE SONT PAS AUTORISEES
ÉPREUVE DE BIOCHIMIE L1S1 DURÉE : 1 h 30
REPONDRE DIRECTEMENT SUR LE SUJET
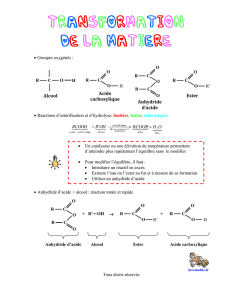
QUESTIONS DE COURS
1 – Les ponts disulfures
Dessinez un pont disulfure avec les 2 acides aminés correspondants.
Un pont disulfure s’établit entre les chaînes latérales de 2 Cystéines.
CH - CH2 - S - S - CH2 - CH
Si les deux cystéines sont libres (non enchaînées dans les liaisons peptidiques), on obtient la Cystine
(dessinée ici)
Dans quelles conditions les ponts disulfures se forment –ils ?
La formation du pont disulfure est une réaction d’oxydation, il faut donc que les cystéines soient dans
un milieu oxydant et non pas réducteur. Comme le cytosol est un milieu réducteur, il n’y a pas de pont
disulfure dans les protéines cytosoliques.
Quel réactif peut-on utiliser pour les rompre ?
On peut les réduire par le β-mercaptoéthanol ou par le dithiothréitol. On peut également les oxyder
par l’acide performique.
2 – Structure primaire des protéines
Comment appelle-t-on le premier résidu d’une protéine ? Pourquoi ?
On l’appelle résidu N-terminal ou amino-terminal car c’est l’acide aminé qui garde sa fonction amine
en α libre (non engagée dans une liaison peptidique).
Mêmes questions avec dernier résidu ?
On l’appelle résidu C-terminal ou carboxy-terminal car c’est l’acide aminé qui garde sa fonction acide
carboxylique libre (non engagée dans une liaison peptidique).
-OOC
+
3HN
COO-
NH3
+

Page 2 sur 6
UNIVERSITÉ PARIS XII-VAL DE MARNE Numéro d'anonymat………………………………
FACULTÉ DES SCIENCES ET TECHNOLOGIE DS du 10 avril 2009
LES CALCULATRICES NE SONT PAS AUTORISEES
ÉPREUVE DE BIOCHIMIE L1S1 DURÉE : 1 h 30
Citez 2 enzymes protéolytiques en précisant leur spécificité d’action.
Aminopeptidase : hydrolyse sélectivement la première liaison peptidique et détache le premier acide
aminé (puis le deuxième, … etc)
Carboxypeptidase : hydrolyse sélectivement la dernière liaison spécifique et détache le dernier acide
aminé (puis l’avant-dernier, … etc)
Trypsine : hydrolyse la liaison peptidique côté C de Lys (K) et Arg (R)
Chymotrypsine : hydrolyse la liaison peptidique côté C de Tyr (Y), Phe (F) et Trp (W)
La protéase V8 de Streptococcus aureus : hydrolyse la liaison peptidique côté C de Asp (D) et Glu (E)
(seulement de Glu dans certaines conditions de tampon)
3 – Structure secondaire des protéines :
Qu’appelle-t-on structure secondaire d’une protéine ?
La structure secondaire est la conformation spatiale répétitive régulière de segments de la chaîne
protéique (hélice , feuillet , tour β)
Quelle est la principale force qui maintient la structure secondaire des protéines ?
La liaison hydrogène.
EXERCICES
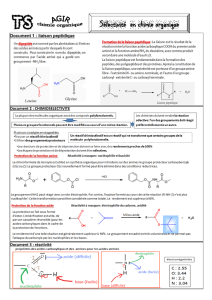
I - Après avoir rappelé quelle forme d’un acide aminé le pH isoélectrique (pHi) caractérise, et donné
les domaines de prédominance de chacun des acides aminés suivants, calculez les valeurs des pHi de
ces acides aminés à partir des valeurs des pK des groupements ionisables à 25°C.
pK1 (COOH)
pK2 (NH2)
pKR (chaîne latérale)
Asp (D)
2,0
9,9
3,9
His (H)
1,8
9,2
6,0
Tyr (Y)
2,2
9,2
10,1
Le pHi caractérise la forme zwitterionique (globalement neutre) d’un acide aminé.
Il est obtenu en faisant la moyenne arithmétique des 2 pK entourant la zone de prédominance du
zwitterion.
pH
2,0
3,9
9,9
3HN
HOOC
3HN
CH – CH2 - COOH
+
-OOC
3HN
+
CH – CH2 - COO-
2HN
CH – CH2 - COO-
-OOC
CH – CH2 - COOH
+
-OOC
Asp

Page 3 sur 6
UNIVERSITÉ PARIS XII-VAL DE MARNE Numéro d'anonymat………………………………
FACULTÉ DES SCIENCES ET TECHNOLOGIE DS du 10 avril 2009
LES CALCULATRICES NE SONT PAS AUTORISEES
ÉPREUVE DE BIOCHIMIE L1S1 DURÉE : 1 h 30
3HN – CH – COOH 3HN – CH – COO- 3HN – CH – COO-
2HN – CH – COO-
3HN – CH – COOH 3HN – CH – COO- 2HN – CH – COO-
2HN – CH – COO-
Ce qui fait pour les pHi :
Pour Asp : (2 + 3,9)/2 = 2,85
Pour His : (6 + 9,2)/2 = 7,5
Pour Tyr : (2,2 + 9,2)/2 = 5,6
II –
Une protéine P contient 0,905 % en poids de tyrosine ? Sachant que la masse molaire de la
tyrosine est 181 g.mole-1, calculer la masse molaire minimale de P.
Si on considère que l’on n’a qu’une Tyrosine par protéine :
La masse molaire de P a été déterminée par chromatographie d’exclusion de gel. Il a été
trouvé une valeur approximative de 80 000 g.mole-1.
- Donner brièvement le principe de cette méthode.
Partage qui s'effectue en fonction de la taille des molécules. On utilise des supports sphériques troués
de pores dans lesquels les solutés pénétreront ou non, selon leur taille : les molécules sont d'autant
plus retenues qu'elles sont petites. (Le support solide est constitué de polymères, dont les chaînes sont
plus ou moins pontées pour varier la taille des pores, et qui gonflent en se remplissant d'eau).
CH2
CH2
CH2
NH+
HN
1,8
pH
6
+
+
+
9,2
9,2
CH2
CH2
pH
+
+
10,1
OH
CH2
OH
CH2
OH
CH2
O-
2,2
9,2
Tyr
His
NH+
HN
N
HN
N
HN

Page 4 sur 6
UNIVERSITÉ PARIS XII-VAL DE MARNE Numéro d'anonymat………………………………
FACULTÉ DES SCIENCES ET TECHNOLOGIE DS du 10 avril 2009
LES CALCULATRICES NE SONT PAS AUTORISEES
ÉPREUVE DE BIOCHIMIE L1S1 DURÉE : 1 h 30
- En déduire le nombre de tyrosines contenues dans P.
Pour 1 Tyrosine, on avait une protéine de masse moléculaire de 20 000 g.mole-1
Si la chromatographie par tamis moléculaire donne une masse moléculaire de 80 000 g.mole-1, c’est
que la protéine contient 4 Tyrosines.
L’absorbance à 295 nm d’une solution très basique de P donne 0,24. Étant donné que la
tyrosine est le seul acide aminé aromatique de P, calculer la concentration de la tyrosine dans la
solution, sachant que le coefficient d’absorption molaire est : 295 = 1200 L .mol-1.cm-1 (épaisseur de
la cuve : 1 cm).
- Pourquoi mesure-t-on l’absorbance à 295 nm ?
295 nm est la longueur d’onde maximale d’absorption de la tyrosine sous forme déprotonnée (φO-,
telle qu’on la trouve dans une solution de pH >10,5).
- En déduire la concentration de P dans la solution.
Utilisation de la loi de Bee-Lambert : A = ε.l.c
dans l’application numérique, il n’est pas nécessaire de faire apparaître la longueur du trajet optique
(l) puisque ici la cuve fait 1 cm et que l doit être exprimé en cm.
A = 0, 24 U.A.
III – Détermination de la structure d’un hexapeptide P
1°) L’action ménagée sur ce peptide du réactif d’Edman permet de mettre en évidence du PTH-Asp.
Une hydrolyse totale du peptide restant en milieu HCl 6N à chaud aboutit à l’identification des
acides aminés suivants : Phénylalanine, Méthionine, Tyrosine, Lysine. Ils sont tous à la même
concentration ; un seul acide aminé est à la concentration double des autres.
Quelles conclusions peut-on tirer de ces expériences ? Pourquoi ?
Hexapeptide : 6 résidus
P = N
-
-
-
-
-
C
4 acides aminés libérés après hydrolyse acide (dont 1 en concentration double)
Puisque après action du réactif d’Edman (qui réagit avec l’acide aminé en N-terminal) on obtient un
PTH-Asp, c’est que le peptide commence par Asp
P = NAsp -
-
-
-
-
C

Page 5 sur 6
UNIVERSITÉ PARIS XII-VAL DE MARNE Numéro d'anonymat………………………………
FACULTÉ DES SCIENCES ET TECHNOLOGIE DS du 10 avril 2009
LES CALCULATRICES NE SONT PAS AUTORISEES
ÉPREUVE DE BIOCHIMIE L1S1 DURÉE : 1 h 30
2°) Le traitement de P par la chymotrypsine permet d’obtenir trois dipeptides B, C et D.
Après avoir rappelé le rôle de la chymotrypsine, quelles conclusions-pouvez-vous
tirer ?
La chymotrypsine hydrolyse la liaison peptidique côté C de Tyr (Y), Phe (F) et Trp (W). Il y a 2
aromatiques dans le peptide, une Phe et une Tyr, donc 2 sites de coupure ce qui génère bien 3
peptides. De plus, pour avoir 3 dipeptides, il faut que les acides aminés aromatiques soit en position 2
et 4 :
= NAsp -
-
-
-
-
C
3°) L’action de la trypsine sur P libère deux peptides E et F.
Une action très brève de la carboxypeptidase sur E et F permet d’identifier respectivement la
Lysine et la Tyrosine. Rappeler le rôle de la trypsine et celui de la carboxypeptidase. Conclusions ?
La trypsine hydrolyse la liaison peptidique côté C de Lys (K) et Arg (R). Dans le peptide il y a une Lys, 1
site de coupure. C’est normal de trouver 2 peptides.
La carboxypeptidase hydrolyse la dernière liaison peptidique et libère le dernier acide aminé.
On retrouve ici les 2 résidus qui terminent les 2 peptides issus de l’hydrolyse par la trypsine. La Lysine
termine nécessairement le premier peptide (celui qui contient le résidu N-terminal de P) et la Tyrosine
est donc l’acide aminé qui est en position C-terminale de P.
P = NAsp …………Lys…………………TyrC
E F
Puisqu’en position 2 et 4 il y a des aromatiques, c’est donc que la Lysine se trouve en position 3
P = NAsp -
-Lys -
-
-TyrC
De plus, puisqu’il y a une tyrosine en C-terminal, c’est donc que c’est un aromatique qu’on retrouve 2
fois dans la séquence (sinon il n’y aurait pas 2 sites de coupure).
L’action ménagée du réactif d’Edman sur E et F libère respectivement du PTH-Asp et du PTH-
Tyr. Conclusions ?
Les acides aminés libérés par le réactif d’Edman sous forme PTH-AA sont les résidus N-terminaux des
2 peptides obtenus après action de la trypsine. Donc on a une Tyrosine qui commence F (puisque Asp
commence nécessairement E). Or on a une Tyr qui finit F. C’est donc Tyr qui est en double.
P = = NAsp -
-Lys -Tyr -
-TyrC
 6
6
1
/
6
100%