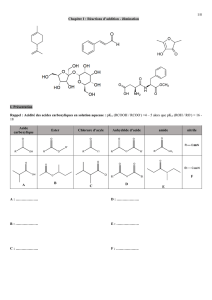
Alcool Acide carboxylique Anhydride d`acide Ester

Groupes oxygénés :
Réactions d’estérification et d’hydrolyse: limitées, lentes, athermiques
Alcooluecarboxyliqacide
OHRRCOOH '
tionesterifica
Eau
Ester
OHRCOOR 2
'
Anhydride d’acide + alcool : réaction totale et rapide
lovemaths.fr
Tous droits réservés
hydrolyse
Un catalyseur ou une élévation de température permettent
d’atteindre plus rapidement l’équilibre sans le modifier
Pour modifier l’équilibre, il faut :
Introduire un réactif en excès
Extraire l’eau ou l’ester au fur et à mesure de sa formation
Utiliser un anhydride d’acide
R
C
O
O
R
C
O
+ R’
OH
R
C
O
O
R’
R
C
O
O
H
+
Anhydride d’acide
Alcool
Ester
Acide carboxylique
R
C
O
Alcool
H
R
C
O
O
H
Acide
carboxylique
R
C
O
O
R
C
O
Anhydride
d’acide
R
C
O
O
R’
Ester

Réaction de saponification : totale et rapide
Savon = partie hydrophile (groupe -COO-) + partie lipophile (groupe alkyle R-) =
espèce amphiphile
Un catalyseur est une substance qui accélère une réaction chimique sans intervenir dans
le bilan de la réaction et sans modifier l’équilibre final de la réaction ; il agit dans les 2
sens de la réaction
On distingue les catalyses homogènes, hétérogènes et enzymatiques (réactions
biochimiques, hautement sélectives)
lovemaths.fr
Tous droits réservés
R2
COO
CH2
R3
COO
CH2
R1
COO
CH2
+ 3 (HO- + Na+)
R2
COO-, Na+
R3
COO-, Na+
R1
COO-, Na+
+
CH2OH
CH2OH
CH2OH
corps gras
soude
savon
glycérol
1
/
2
100%