Chimie organique : Déshydratation d'un alcool - Exercice

Thème : AGIR, Défis du XXI
ème
siècle Act.exp.19: Déshydratation d’un alcool Ch14-TP19
I. Modification de structure chimique
1. Chaîne carbonée et groupes caractéristiques (GC)
Les composés organiques présentent un large éventail de propriétés chimiques principalement
dues à la présence de GC. Par exemple ceux qui ont un GC -COOH sont acides.
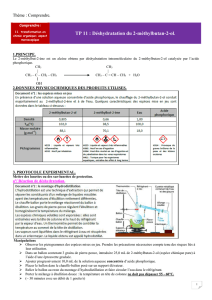
A :
B :
C :
a) Entourer et nommer les GC présents dans les molécules A, B et C puis donner leurs
formules brutes (sur l’énoncé). Nommer ces composés.
b) Si la molécule A est transformée en B, est-ce une modification de chaîne ou de GC ?
c) Même question pour la transformation de B en C.
d) Représenter la formule semi-développée de la molécule d’acide 4-hydroxyhexanoique (D).
e) Cette molécule est modifiée au cours d’une réaction pour donner le 4-hydroxyhexanamide.
Représenter la molécule obtenue. S’agit-il d’une modification de chaîne ou de GC ?
2. Catégories de réaction
Les chimistes ont décidé de classer les réactions dans des grandes catégories qui sont les
substitutions, les additions et les éliminations. La catégorie est obtenue en observant les
modifications de chaîne et de groupe effectuées pour passer des réactifs aux produits.
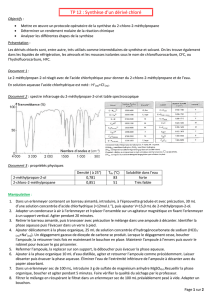
a) L’équation ci-contre représente la
réaction entre l’hex-1-ène et le
dibrome. Entourer les différences entre
le réactif principal et le produit principal.
De quel type de réaction s’agit-il ?
b) Le produit de la réaction précédente est mis en présence d’une base, il se
forme B comme seul produit organique. De quel type de réaction s’agit-il ?
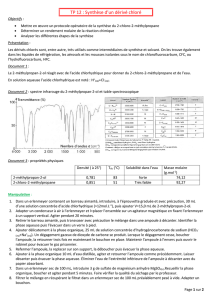
Il est possible d’obtenir des doubles liaisons carbone-carbone à partir de certains alcools.
c) En équilibrant l’équation, identifier C.
A quelle catégorie de réaction cette
réaction appartient ?
L’alcool utilisé dans la réaction précédente est lui-même le produit de la réaction ci-dessous.
d) Identifier D.
A quelle catégorie appartient
ccccette réaction ?
II. Etude expérimentale
En présence d’acide phosphorique, le chauffage du 2-méthylbutan-2-ol conduit majoritairement
au 2-méthylbut-2-ène et à de l’eau.
Hydrodistillation :
Dans un ballon bicol contenant 3 grains de pierre-ponce, introduire 25,0 mL de 2-méthylbutan-2-ol à
l’aide d’une éprouvette graduée.
Ajouter progressivement 10,0 mL de la solution aqueuse concentrée d’acide phosphorique à l’aide
de l’ampoule de coulée.
Placer le ballon dans le montage d’hydrodistillation et faire circuler l’eau dans le réfrigérant.
Porter le mélange à ébullition douce : la température en tête de colonne ne doit pas dépasser 55 -
60°C (~ 30 minutes avec un débit de 1 goutte/s).
Placer l’erlenmeyer destiné à recevoir l’alcène dans un bain d’eau glacée.
Isolement du produit brut :

Transvaser le distillat dans une ampoule à décanter.
Ajouter à la phase organique restante, 20 mL d’une solution aqueuse concentrée
d’hydrogénocarbonate de sodium, Na
+
(aq) + HCO
3-
(aq). Lorsque le dégagement de CO
2
(g) cesse,
boucher l’ampoule, la retourner en maintenant bien le bouchon et ouvrir rapidement le robinet pour
dégazer. Agiter puis, à la fin du dégagement gazeux, refermer l’ampoule, la replacer sur son
support, la déboucher et laisser décanter. Évacuer la phase aqueuse.
Introduire la phase organique restante dans un erlenmeyer contenant deux spatules de sulfate de
magnésium anhydre sec. Placer l’erlenmeyer dans un bain d’eau glacée.
Agiter délicatement et vérifier la qualité du séchage (Des grains de sulfate de magnésium non
agglomérés doivent être présents dans le milieu).
Filtrer la phase organique et la recueillir dans un erlenmeyer préalablement pesé. En déduire la
masse m
exp
de la phase organique. On suppose que cette phase ne contient que d’alcène formé.
Analyse : Test avec l’eau de brome (voir fiche de TP_ 3.b). Noter vos observations.
EXPLOITATION
1) Écrire l’équation de la réaction en utilisant les formules semi-développées des molécules.
Identifier, par une couleur, les atomes de la molécule d’alcool perdus au cours de la réaction.
2) Justifier alors le titre de ce TP (« déshydratation »).
De quel type de réaction s’agit-il (substitution, addition, élimination) ? Justifier.
3) Pourquoi chauffe-t-on le mélange réactionnel ? Quel est le rôle de l’acide phosphorique
dans cette expérience ? Le rôle de la pierre ponce ?
4) Schématiser l’ampoule à décanter avec les phases aqueuse et organique et justifier la
position respective de ces phases. Pourquoi ajoute-t-on la solution d’hydrogénocarbonate de
sodium ?
5) Calculer la quantité initiale d’alcool, notée n(ol), utilisée lors de l’expérience.
Quelle masse maximale d’alcène, notée m
max
, peut-on obtenir ?
6) Définir le rendement η de la réaction, l’exprimer en fonction des masses d’alcène m
max
et
m
exp
puis le calculer.
7) Vérifier, expérimentalement, que l’espèce constituant le distillat comporte bien une double
liaison C = C (Test au dibrome : quelques gouttes se décolorent en présence d’un alcène).
8) Vous possédez deux spectres IR (A et B). Identifier celui qui correspond au réactif (alcool) et
celui du produit (alcène) à l’aide des tables IR dans le rabat V votre livre et en attribuant
chacune des bandes d’absorption sur l’énoncé.
1
/
2
100%