Synthèse du 2-chloro-2-méthylpropane : TP de chimie

Page 1 sur 2
TP 12 : Synthèse d’un dérivé chloré
Objectifs :
Mettre en œuvre un protocole opératoire de la synthèse du 2-chloro-2-méthylpropane
Déterminer un rendement molaire de la réaction chimique
Analyser les différentes étapes de la synthèse
Présentation :
Les dérivés chlorés sont, entre autre, très utilisés comme intermédiaires de synthèse et solvant. On les trouve également
dans les liquides de réfrigération, les aérosols et les mousses isolantes sous le nom de chlorofluorocarbure, CFC, ou
l’hydrofluorocarbure, HFC.
Document 1 :
Le 2-méthylpropan-2-ol réagit avec de l’acide chlorhydrique pour donner du 2-chloro-2-méthylpropane et de l’eau.
En solution aqueuse l’acide chlorhydrique est noté : H+(aq)+Cl-(aq).
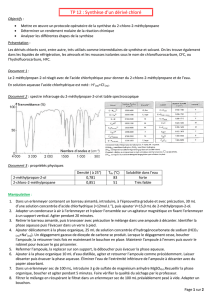
Document 2 : spectre infrarouge du 2-méthylpropan-2-ol et table spectroscopique
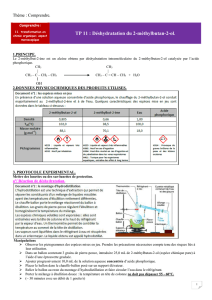
Document 3 : propriétés physiques
Densité ( à 25°)
Téb (°C)
Solubilité dans l’eau
Masse molaire
(g.mol-1)
2-méthylpropan-2-ol
0,781
83
forte
74,12
2-chloro-2-méthylpropane
0,851
51
Très faible
92,27
Manipulation :
1. Dans un erlenmeyer contenant un barreau aimanté, introduire, à l’éprouvette graduée et avec précaution, 30 mL
d’une solution concentrée d’acide chlorhydrique (≈12mol.L-1), puis ajouter V=15,0 mL de 2-méthylpropan-2-ol.
2. Adapter un condenseur à air à l’erlenmeyer et l=placer l’ensemble sur un agitateur magnétique en fixant l’erlenmeyer
à un support vertical. Agiter pendant 20 minutes.
3. Retirer le barreau aimanté, puis transvaser avec précaution le mélange dans une ampoule à décanter. Identifier la
phase aqueuse puis l’évacuer dans un verre à pied.
4. Ajouter délicatement à la phase organique, 25 mL de solution concentrée d’hydrogénocarbonate de sodium (HCO3-
(aq)+Na+(aq)). Un dégagement gazeux de dioxyde de carbone se produit. Lorsque le dégagement cesse, boucher
l’ampoule, la retourner trois fois en maintenant le bouchon en place. Maintenir l’ampoule à l’envers puis ouvrir le
robinet pour évacuer le gaz prisonnier.
5. Refermer l’ampoule, la replacer sur son support, la déboucher puis évacuer la phase aqueuse.
6. Ajouter à la phase organique 10 mL d’eau distillée, agiter et retourner l’ampoule comme précédemment. Laisser
décanter puis évacuer la phase aqueuse. Éliminer l’eau de l’extrémité inférieure de l’ampoule à décanter avec du
papier absorbant.
7. Dans un erlenmeyer sec de 100 mL, introduire 3 g de sulfate de magnésium anhydre MgSO4(s).Recueillir la phase
organique, boucher et agiter pendant 5 minutes. Faire vérifier la qualité du séchage par le professeur.
8. Filtrer le mélange en récupérant le filtrat dans un erlenmeyer sec de 100 mL préalablement pesé à vide. Adapter un
bouchon.

Page 2 sur 2
Questions :
a. Écrire l’équation de la réaction chimique étudiée en notant les composés organiques en formule semi-développée.
Comment est modifiée la structure de la molécule de départ au cours de la réaction ?
CH3C CH3
CH3
OH +H+CH3C CH3
CH3
Cl +OH2
Le groupe hydroxyl , OH, de l’alcool a été remplacé par un atome de chlore Cl.
b. Repérer la ou les bandes d’absorption caractéristique(s) du réactif sur le spectre IR présent sur le document 2. Les
molécules de 2-méthylpropan-2-ol sont-elles liées par des liaisons hydrogènes ?
Il y a 2 bandes d’absorption caractéristiques :
- La bande large et forte à = 3300 cm-1 caractéristique de la présence du groupe OH, cette bande indique que
les molécules d’alcool sont liées par liaison hydrogène.
- La bande fine et forte à σ=2900 cm-1 est caractéristique des liaisons Carbone_tétraédrique-hydrogène, Ctét-H.
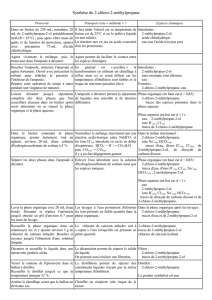
c. Observer les pictogrammes des réactifs utilisés. Rechercher les risques que peut présenter leur utilisation et
s’organiser en conséquence.
Les pictogrammes visibles : Xn, Inflammable et Corrosif. Par prudence il est recommandé
d. L’ion hydrogénocarbonate HCO3-(aq) réagit avec les ions hydrogène H+(aq) pour donner du dioxyde de carbone et de
l’eau. Écrire l’équation de la réaction.
HCO3-(aq) + H+(aq) ➔ CO2(g),H2O(l)
e. Pourquoi rince-t-on la phase organique à l’eau distillée ? N’y a-t-il pas un risque de perdre le produit ? Justifier.
Le rinçage à l’eau distillée permet d’évacuer l’acidité restante dans l’ampoule et rincer sa paroi. Le produit étant peut
soluble dans l’eau, il y a peu de risque d’en perdre.
f. Le sulfate de magnésium anhydre permet de sécher la phase organique grâce à la réaction d’équation :
MgSO4(s) + 7H20(l) ➔ MgSO4,7H2O(s)
En quoi consiste le “séchage” de la phase organique ?
Le « séchage » consiste à éliminer l’eau résiduelle présente dans la phase organique.
g. Quelles techniques permettraient de vérifier la nature du produit obtenu ?
Le produit peut être identifier soit par spectroscopie( RMN ou IR) ou par chromatographie sur couche mince.
h. Déterminer le rendement molaire de la synthèse
. Dresser un tableau d’avancement.
On détermine la quantité de matière d’alcool prélevé :
L’application numérique donne :
L’alcool est le réactif limitant car nHCl=12x30.10-3=0,36 mol.De ce fait xmax=1,56.10-1 mol.
Le calcul du rendement sera :
i. En utilisant les trois termes, « addition », « substitution » ou « élimination », rédiger une phrase décrivant la nature
de la réaction de synthèse réalisée.
Le remplacement du groupe hydroxyl, OH, de l’alcool par un groupe chloro, Cl, conduit à une synthèse par substitution.
1
/
2
100%