DESHYDRATATION D`UN ALCOOL ….ÇA GAZE ?? Objectifs

DESHYDRATATION D’UN ALCOOL ….ÇA GAZE ??
Objectifs : Pratiquer une démarche expérimentale pour synthétiser une molécule organique.
Identifier un produit formé à l’aide de spectres fournis.
Info 1
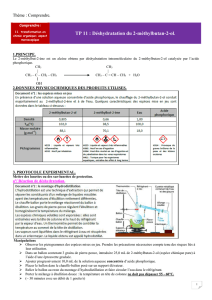
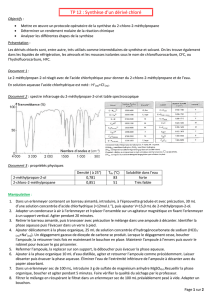
2-méthylbutan-2-ol
2-méthylbut-2-ène
Acide phosphorique
Densité
0,806
0,662
1,83
T°eb (°C)
102
38,5
T°fus (°C) = 42,4
Solubilité dans l’eau
peu soluble
insoluble
soluble
Masse molaire
(M en g.mol-1)
88,0
70,0
98,0
Sécurité
Protocole opératoire de la distillation du 2-méthylbutan-2-ol :
Durant la période de chauffe, tout en contrôlant la température, répondre aux questions
suivantes :
1. Faire le schéma annoté du montage de distillation.
2. Quel est le rôle des grains de pierre ponce ?
3. Ecrire l’équation de la réaction de déshydratation du 2-méthylbutan-2-ol.
4. Quel est le rôle de l’acide phosphorique ?
Récupération de la phase organique :
5. Comment repère-t-on la phase aqueuse ?
6. Faire un schéma annoté de l’ampoule à décanter.
7. Quelles sont les espèces susceptibles d’être présentes dans la phase organique, la réaction
étant supposée terminée ?
Lavage de la phase organique :
* Dans un ballon contenant quelques grains de pierre ponce (au bureau), introduire, sous hotte, 25 mL de
2-méthylbutan-2-ol, puis 10 mL d’acide phosphorique H3PO4.
* Placer le ballon dans un chauffe-ballon posé sur un support élévateur, en position haute, et fixer le au
montage de distillation.
* Placer l’erlenmeyer destiné à recevoir le distillat dans un bain d’eau glacée.
* Porter à ébullition douce, sans dépasser 45°C en tête de colonne (le contrôle du chauffage se fait en
abaissant ou en montant légèrement le chauffe-ballon à l’aide du support élévateur).
* Arrêter de chauffer et baisser le support élévateur lorsque le débit du distillat devient négligeable (≈ 30
min)
* Transvaser, à l’aide d’un entonnoir, le distillat dans une ampoule à décanter. Laisser reposer.
On obtient un liquide présentant 2 phases : une phase aqueuse, contenant de l’eau et des espèces
dissoutes dans l’eau et une phase organique contenant des espèces non solubles dans l’eau.
* Evacuer la phase aqueuse (pour l’identifier facilement, verser de l’eau distillée dans l’ampoule et
observer pour quelle phase le volume augmente).
* Ajouter à la phase organique 20 mL d’une solution saturée d’hydrogénocarbonate de sodium (Na+ +
HCO3-). Il se forme alors un dégagement gazeux de dioxyde de carbone ; lorsqu’il cesse, boucher l’ampoule,
la retourner en maintenant bien le bouchon, ouvrir le robinet pour dégazer.

8. Avec quelle espèce réagissent les ions hydrogénocarbonate pour former le dioxyde de
carbone gazeux ? Justifier la basicité de la phase aqueuse.
9. Que reste-t-il à nouveau dans la phase organique ?
Sèchage et pesée de la phase organique :
10. Quel est le rôle du sulfate de magnésium anhydre?
Test de reconnaissance du groupe caractéristique du produit synthétisé :
11. Que peut-on déduire de cette réaction ?
En continu : Faire vérifier la
réalisation
REA Suivre un protocole donné
0
1
2
3
J’ai réussi si les expériences sont réalisées correctement et avec soin.
Exploitation :
12. Déterminer la masse d’alcène obtenue.
13. En déduire le rendement de la synthèse : rendement =
14. En utilisant le spectre I.R. ci-contre
du produit organique obtenu, vérifier
qu’il s’agit d’un alcène.
15. Utiliser un des termes suivants pour
caractériser la réaction effectuée lors de
cette synthèse : « addition »,
« élimination » ou « substitution ».
Justifier.
16. Cette réaction peut donner, en faible
quantité, un autre alcène isomère du 2-méthylbut-2-ène. Donner sa formule et son nom.
* Introduire la phase organique restante dans un erlenmeyer sec contenant deux spatules de sulfate de
magnésium anhydre.
* Boucher, puis agiter délicatement pendant 1 minute jusqu’à la fin du séchage : la phase organique est
sèche lorsqu’il existe des grains de sulfate de magnésium non agglomérés dans le liquide.
* Peser un erlenmeyer sec avec son bouchon : masse m1 = ……………..
* Filtrer la phase séchée précédente et récupérer le filtrat dans l’erlenmeyer pesé à vide. Peser à nouveau
l’erlenmeyer bouché avec le filtrat : masse m2 = …………………..
Info 2 : couples acido-basiques CO2,H2O / HCO3- ; H3PO4 / H2PO4 –
* Sous hotte, verser environ 1 mL de produit obtenu dans un tube à essais. Ajouter quelques gouttes d’eau
de dibrome.
Info 3: l’eau de dibrome orange est décolorée par un alcène
Agiter alors délicatement, puis dégazer. A la fin du dégagement gazeux, reposer l’ampoule sur son support
et laisser décanter en ayant ôté le bouchon.
* Eliminer la phase aqueuse et vérifier qu’elle est devenue basique avec le papier pH.
1
/
2
100%