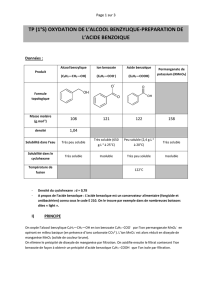
TP1 - 23 Acide benzoique

Faculté des Sciences
Section de chimie et biochimie
Département de chimie physique
Travaux Pratiques de chimie organique
Par
M. Laverrière Romain
Assistante
Dr. Tortoreto Cecilia
Genève
2011
23. Acide benzoique

1/7
1. But de lʼexpérience
Le but de cette réaction est dʼobtenir de lʼacide benzoïque par oxydation de
lʼéthylbenzène, favorisée par du permanganate (puissant oxydant).
Lʼacide benzoïque est très utilisé dans lʼagroalimentaire comme conservateur.
2. Manipulations
Une solution de Na2CO3 (5 g), de KMnO4 (10 g) ainsi que dʼéthylbenzène (3
g) a été préparée dans un ballon de 500 mL avec 150 mL dʼeau.
Puis, la solution est placée à reflux pendant au moins 1h30, après quoi la
solution a été acidifiée (env. 50 mL de HCl concentré) et le MnO2 (précipité
brun) dissout par addition de Na2SO3 (3 g).
Ensuite, la précipitation a été compétée en plaçant le ballon dans un bain de
glace.
Finalement, le précipité a été filtré et recristallisé dans lʼeau (150 mL).
3. Mécanisme de réaction[1]
Le mécanisme détaillé de la réaction serait le suivant, même si le processus
dʼoxydation par KMnO4 reste encore peu connu :
Dans un premier temps, le milieu basique va déprotoné lʼéthylbenzène, ce qui
provoque la formation dʼun carbocation. Puis, la charge positive présente va
être attaquée par le permanganate en solution, ce qui engendre la formation
dʼune fonction alcool puis dʼune cétone par oxydation. Une tautomérisation
céto-énolique sʼeffectue alors et la double liaison qui en résulte est oxydée.
Ainsi, il y a production dʼacide benzoïque, de MnO2- et de méthanal.
OH
base
O
Mn O
O
O
O
H
Mn OO
O
O
tautom. OH2
OH
MnO4
-
OO
Mn
OO
OH
OMn
O
O
O

2/7
4. Résultats & Discussion
4.1. Rendement
La stœchiométrie de la réaction nous montre que le nombre de mol de réactif
(éthylbenzène = 28.3 mmol) est théoriquement égal au nombre de mol du
produit (acide benzoïque). On peut donc calculer le rendement avec la masse
dʼacide benzoïque obtenue :
Masse obtenue (g)
0.4789
Mole obtenue (mmol)
3.922
Mole théorique (mmol)
28.3
Rendement
13.9 %
Aucune valeur théorique nʼa pu être trouvée en ce qui concerne le rendement
mais celui-ci semble quand même un peu bas, dʼautant plus que le pH de la
solution était au moins de 2 avant chaque filtration (à chaud ou à froid) afin de
maximiser la présence de cristaux (lʼacide protoné est moins soluble).
En effet, même si on considère que lʼutilisation dʼeau comme solvant de
recristallisation induit quʼune partie du produit soit perdue (en solution
aqueuse : un acide est régit selon sa constante dʼéquilibre Ka) et que
beaucoup trop dʼeau a été utilisée pour la recristallisation, ces pertes
devraient être compensée par le fait que le ballon a été passer au rotavap (la
masse était si insignifiante que cela a été nécessaire).
Ainsi, la seule manipulation ayant pue engendrer des pertes est la filtration a
froid au Büchner.
4.2. Spectre infra-rouge (Annexe 2)
Lʼanalyse du spectre infra-rouge permet
dʼidentifier la présence du produit final. En
effet, comme on peut le voir, tous les pics
attendus sont présents de manière assez
précise, sauf pour le pic à 2848 au lieu de
2688. Ce pic correspond à lʼélongation de
la liaison O-H et reste tout-de-même dans
le bon intervalle (2500-3000).
On confirme la présence dʼacide
benzoïque notamment grâce au pic
majoritaire à 1683, correspondant au
groupement cétone.
Certains pics présents dans le spectre ne
devraient pas sʼy trouver (1496, 1454,
997, 853) dʼaprès la littérature. Cela est
peut-être dû à un produit parasite voir
même une impureté.
Pics IR littérature
Pics IR pratiques
3076
3071
2688
(2848 ?)
2564
2560
1675
1683
1607
1602
1587
1582
1429
1422
1333
1324
1292
1290
1179
1179
1126
1125
1075
1065
1030
1027
934
931
812
807
705
706
684
684
666
666

3/7
4.3. Spectre RMN (Annexe 3 & 4)
H
δ(exp.) (ppm)
δ(litt.) (ppm)
Intégrale
x2 = Nbr de H
(1)
7.609-7.646
7.66
0.53
1
(2)
7.472-7.510
7.79
1.06
2
(3)
8.115-8.133
8.21
1.00
2
(4)
-
~11
-
-
Ainsi, le spectre confirme bien la présence dʼacide benzoïque. Néanmoins, il
subsiste quelques impuretés à 1.209-1.276 (les autres pics étant le solvant
CDCl3 à 7.270 ppm et lʼeau à 2.033 ppm).
Un pic attire lʼattention de par sa magnitude à 2.184 ppm. Cela correspond
probablement à de lʼacétone (litt. 2.13 ppm) qui nʼest pourtant pas censé être
présent mais qui provient du nettoyage du tube à RMN.
5. Conclusion
Finalement, la réaction sʼest relativement bien passée, le produit étant bien
de lʼacide benzoïque. Cependant, il nʼest malheureusement pas
complétement pur. Le rendement nʼest pas exceptionnel mais cela est
souvent le cas lors de recristallisation à lʼeau. Peut être quʼune extraction
aurait été plus indiquée.
O
OH
H(1)
H(2) H(3)
H(4)
H(3)
H(2)

4/7
6. Exercices
6.1. Lʼoxydation de la chaine dʼun composé aromatique se fait toujours au
carbone qui est le plus près du noyau aromatique. Expliquez ce fait.
La charge positive pouvant être délocalisée (dû aux électrons délocalisés du
cycle benzène), cela permet de stabiliser lʼétat de transition. Plus le
carbocation est proche du cycle, plus lʼeffet stabilisant sera fort.
6.2. Comparez lʼacidité des acides benzoïque, acétique et oxalique.
De la même manière que pour lʼéthylbenzène, lʼacide benzoique à un état
déprotoné stabilisé par la délocalisation des doubles liaisons.
On devrait donc sʼattendre à ce que son pKa soit au moins plus petit que celui
de lʼacide acétique.
Acides
pKa[1]
Benzoïque
4.2
Acétique
4.8
Oxalique
1.2 et 4.3
Cela se confirme donc dans la littérature. Lʼacide oxalique étant diprotique, il
est normal quʼil soit plus fort, du moins pour la première dissociation.
Il sʼen suit donc que lʼordre dʼacidité décroissant va comme suit :
Oxalique > Benzoique > Acétique
7. Sources bibliographiques
[1] Vollhart-Schore, Traité de chimie organique, 4ème édition française, (2004)
[2] http://www.Sciencelab.com/
O
OH
benzoic acid
O
OH
acetic acid
O
OHO
HO
oxalic acid
 6
6
 7
7
 8
8
1
/
8
100%