aspect clinique des troubles moteurs primitifs de l`oesophage

ASPECT CLINIQUE DES TROUBLES MOTEURS PRIMITIFS DE L'OESOPHAGE
(ACHALASIE - SPASMES DIFFUS).
Etienne-Henry Metman ,S Debbabi, L Picon
Service des maladies de l'appareil digestif. CHU Trousseau - 37044 Tours cedex
Tel 02 47 47 59 16 Fax 02 47 27 04 64
Les troubles moteurs primitifs de l'œsophage regroupent cliniquement l'achalasie, la maladie des spasmes diffus (MSD) et
les formes intermédiaires. Ils apparaissent isolés, s'opposant aux troubles moteurs secondaires qui s'intègrent dans une
maladie générale ou néoplasique. Les troubles moteurs non spécifiques sont un cadre dont la nosologie reste imprécisée. Le
diagnostic d'une maladie motrice primitive ne peut être envisagé qu'après avoir éliminé formellement une lésion organique.
Les signes d'appel des troubles moteurs de l'oesophage sont la dysphagie, les douleurs thoraciques et les régurgitations.
L'ACHALASIE (CARDIOSPASME, MÉGAOESOPHAGE IDIOPATHIQUE).
L'achalasie est un trouble de la motricité oesophagienne du à un défaut acquis du contrôle nerveux intrinsèque.
L'apéristaltisme est constant de même que l'absence de relaxation du sphincter inférieur de l'oesophage (SIO), parfois
seulement apparemment normal (1)Le cardiospasme est inconstant.
L'incidence de l'achalasie est faible : environ 0,8/100.000 habitants par an (3). Elle peut survenir à tous les âges.. Elle est
rare chez l'enfant. Les symptômes débutent avant l'âge de 14 ans chez seulement 5 % des malades . Le sex ratio est
proche de 1. Un contexte familial est possible : la transmission serait autosomique récessive. La fréquence de ces formes
familiales est rare : 1 à 2 % des patients. Nous en avons trouvé 3 cas ( 6 malades) parmi plus de 360 patients pris en
charge pour dilatation pneumatique.
PHYSIOPATHOLOGIE
Les lésions anatomiques touchent essentiellement le système nerveux intrinsèque avec disparition ou raréfaction des
cellules ganglionnaires des plexus d'Auerbach et altération des filets nerveux préganglionnaires . La dénervation inhibitrice
prédomine au niveau du SIO avec disparition des neurones VIPergiques et de la NO synthétase. L'oxyde nitrique ou NO est
le neuro-médiateur principal des fibres vagales non adrénergiques - non cholinergiques.(1)
L'étiologie est inconnue. Trois hypothèses ont été proposées pour expliquer la dénervation : affection auto-immune,
processus nerveux dégénératif (analogue aux lésions centrales du parkinson), enfin infectieuse, impliquant un virus
neurotoxique ou un autre organisme pathogène. Un travail récent suggérait que l'agent étiologique pourrait être le virus
varicelle-zona mais n'a pas été confirmé (2).
SIGNES CLINIQUES
La dysphagie basse est quasi constante , souvent d'évolution capricieuse et intermittente au début ; l'aggravation est
progressive mais très variable pouvant s'étendre sur quelques mois ou de longues années. Elle peut aboutir à l'aphagie
totale au moment du diagnostic ou à des épisodes de blocage aigus (3) Elle est sélective pour les solides dans un cas sur
deux mais survient pour les liquides et les solides chez 40 % des malades. Une dysphagie paradoxale isolée pour les
liquides n'est notée que dans 7 à 10% des cas. La progression des aliments est parfois favorisée par l'ingestion d'un volume
important de liquide, ou des manoeuvres telles que la position debout , l'élévation des bras au-dessus de la tête,
l'hyperextension du tronc ou l'effort d'expiration glotte fermée. Une analyse sémiologique bien menée suggère le diagnostic
de maladie motrice de l'œsophage chez 80 % des patients dysphagiques qui en sont porteurs bien que la dysphagie puisse
être ressentie au niveau cervical, aussi bien que thoracique haut ou bas (4). Cependant le retard diagnostique habituel est
de 4 à 7 ans dans les séries anciennes ou récentes(cf tableau 1) à l'exception du travail prospectif d'Edinburgh ou le délai
moyen entre début des symptômes et diagnostic est de 19 mois en 1992 (3). Les raisons de ce délai diagnostique tiennent
au patient qui modifie insensiblement ses habitudes alimentaires et aux praticiens vite rassurés par la normalité de
l'endoscopie haute . Récemment Eckardt et al. dans leur série de 87 patients étudiés depuis 1980 ne retrouvent
d'association significative entre délai diagnostique et caractéristiques d'évolution qu'avec le nombre de praticiens consultés
(9)
La douleur thoracique est souvent au second plan : 19 à 79 % des patients sont concernés(cf tab 1), mais lorsque des
douleurs thoraciques révèlent un trouble moteur oesophagien, il s'agit d'une achalasie dans moins de 2 % des cas (10) (cf
tableau 2). Elle est surtout présente au début de l'évolution et tend à s'estomper avec les années, avec ou sans traitement
(15) La douleur est habituellement rétrosternale, à type de striction, pseudo-angineuse, diurne ou nocturne indépendante
des repas. L'odynophagie est possible. Mais il peut s'agir de brûlures rétrosternales difficiles à distinguer de douleurs liées à
un reflux gastro-oesophagien. La confusion diagnostique avec le reflux n'est pas rare au début (3) et peut amener à des
interventions antireflux intempestives. Dans l'étude de Howard et coll. 5 patients sur 38 souffraient de brûlures, 7 étaient
sous antiH2 et 8 sous antiacides (3). Un reflux gastro-oesophagien vrai, intriqué peut précéder la dysphagie de quelques
mois à deux ans et disparaître à son'apparition (16).Parfois les brûlures persistent ou apparaissent avec la dysphagie(16).
En pHmétrie un reflux vrai peut être noté mais une acidification lente liée à la fermentation lactique du bol alimentaire
stagnant dans l'oesophage est plus fréquente.(17) .La brûlure est mal corrélée à ces deux mécanismes d'acidification. Les
douleurs diurnes ou nocturnes semblent dues, le plus souvent, à des contractions musculaires à type de spasme, plus
fréquentes dans la forme vigoureuse de l'achalasie. Des brûlures rétrosternales peuvent révéler une oesophagite
médicamenteuse ou candidosique.
Les régurgitations alimentaires sont présentes trois fois sur 4 au moment du diagnostic. Elles surviennent à la phase
initiale en période post-prandiale précoce (régurgitations actives) et à la phase tardive la nuit (régurgitations passives),
favorisées par le décubitus (5). L'interrogatoire permet de distinguer ces régurgitations fades, d'aliments non digérés ou de
salive, d'un reflux ou de vomissements. Le caractère positionnel, tant à l'antéflexion qu'au décubitus des régurgitations
passives est un autre élément qui peut égarer le clinicien vers un reflux.
Les symptômes respiratoires sont présents dans 22 à 46 % des cas, ils sont parfois révélateurs. La toux paroxystique
nocturne est le signe le plus fréquent de l'aspiration trachéale ; dix % des patients présentent une pneumopathie
d'aspiration aiguë ou chronique dans les séries anciennes (6). Une forme particulière d'asphyxie par compression trachéale
due à la distension aérique majeure de l'oesophage cervical a été décrite (1). Le mécanisme en cause est une perte du
réflexe d'éructation avec absence de relaxation du sphincter supérieur de l'oesophage.(18)
Le plus souvent la durée d'évolution des symptômes est supérieure à un an, et un amaigrissement est noté lors du
diagnostic dans 60 % des cas en moyenne (cf tab 1). Il s'aggrave rapidement aux stades tardifs mais peut être
précocément important chez quelques malades .
TABLEAU 1 - PRÉVALENCE %
ET
ANCIENNETÉ
DES
SYMPTÔMES
CLINIQUES
AU
MOMENT
DU
DIAGNOSTIC
DE
L'ACHALASIE
Référence
Nombre de
malades
Dysphagie
Régurgitations
Amaigrissement
Douleurs
thoraciques
Toux
Durée
d'évolution
Vantrappen et
al,1971 [5]
264
99
91a
91
46
30
7,6 ans

a : Régurgitations actives : 91 % et régurgitations passives de décubitus : 57 %
EXAMENS COMPLEMENTAIRES
L'endoscopie oesophagienne est l'examen de première intention devant une dysphagie. Elle va démontrer l'absence de
sténose organique ou de lésions sur le bas-œsophage, le cardia et la grosse tubérosité. Le cardiospasme réalise une image
de rosette muqueuse permanente, sans l'ouverture intermittente spontanée ou sous l'effet de l'insufflation d'un cardia
normal. Le rétrécissement est aisément franchi par pression douce de l'endoscope avec un ressaut au passage du cardia.
L'impossibilité de franchir la sténose cardiale exclut le diagnostic d'achalasie. En cas de stase alimentaire, un lavage
soigneux est nécessaire pour contrôler l'aspect de la muqueuse : dépolie ou blanchâtre par oesophagite de stase ou par
candidose. Avant traitement nous n'avons jamais rencontré de lésions typiques d'oesophagite peptique . L'oesophagite de
stase donne un aspect épaissi, blanchâtre parsemé d'ulcérations de petite taille superficielles. Toute anomalie doit être
biopsiée en raison du risque de greffe néoplasique L'achalasie secondaire par cancer gastrique sous-cardial à extension
sous-muqueuse peut être indiscernable de l'achalasie idiopathique ; en cas de suspicion clinique ou endoscopique des
biopsies sous-cardiales systématiques peuvent être utiles.
Le transit baryté oesogastrique peut mettre en évidence la perte des contractions péristaltiques et la présence de
contractions tertiaires, la stagnation ou le mouvement rétrograde de la baryte, l'insuffisance des passages vers l'estomac.
Le défaut de relaxation du SIO se traduit par un rétrécissement régulier en queue de radis ou en bec d'oiseau du cardia. Un
diverticule épiphrénique peut être associé dans 5% des cas
Dans les formes évoluées, l'œsophage est dilaté. L'allongement de l'oesophage donne un aspect « en chaussette » à un
stade tardif. La distension et la rétention liquidienne entraînent des anomalies sur les radiographies sans préparation :
niveau liquide intra-thoracique, opacité médiastinale postérieure. Ces signes tardifs sont encore aujourd'hui rencontrés et
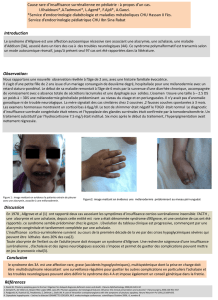
méconnus. Ces deux dernières années nous avons vu trois patientes chez qui le diagnostic n'a été porté que sur un
examen tomodensitométrique motivé par des douleurs thoraciques avec élargissement du médiastin sur le cliché de thorax
(fig 1a et 1b) La disparition de la poche à air gastrique est un signe accessoire et tardif.
En pratique le radiologue n'évoque le diagnostic d'achalasie que 2 fois sur 3 (3,19) ce qui est mieux que l'endoscopie et
moins que la vidéoradiographie ou la scintigraphie oesophagienne pour les auteurs nord-américains( 19)
La manométrie oesophagienne permet d'affirmer le diagnostic sur l'association de deux signes : l'apéristaltisme
oesophagien et l'achalasie du SIO, qui se traduit par une relaxation inférieure à 80 % après plus de 80 % des déglutitions
(nadir > 10 mm Hg) [1,14,19]. La relaxation apparemment normale qui est notée dans 10 % des cas, dans les formes de
début, est trop courte ou incomplète lorsqu'elle est étudiée avec la sonde à manchon de Dent [1].
TABLEAU 2 – PRÉVALENCE
DES
DIAGNOSTICS MANOMÉTRIQUES
CHEZ
LES MALADES PRÉSENTANT
DES
DOULEURS THORACIQUES AVEC BILAN
CARDIAQUE NÉGATIF (
D
'APRÈS
K
AHRILAS
ET
AL [14]).
DIAGNOSTIC DIFFERENTIEL
Il est en général facile : c'est la manométrie qui permet de distinguer l'achalasie des autres maladies motrices primitives de
l'œsophage et des troubles moteurs secondaires. L'apéristaltisme peut être noté dans le reflux gastro-oesophagien sévère,
la sclérodermie et l'œsophage adynamique du vieillard. Dans ces trois cas, le SIO est incompétent .
Mais la manométrie ne permet pas de distinguer l'achalasie de la pseudo-achalasie par
cancer infiltrant de l'œsophage distal ou du cardia. Une apparition récente des symptômes contrastant avec un
amaigrissement important (plus de 7 kilos en moins d'un an) après 60 ans doit faire évoquer ce diagnostic(20). L'achalasie
tumorale représente 5 % de toutes les séries d'achalasie manométriques. C'est dire l'importance d'une bonne exploration
endoscopique et la nécessité de réaliser des biopsies sur toute anomalie de relief du cardia ou de la région sous-cardiale.
Les signes endoscopiques suspects sont des ulcérations muqueuses, un aspect nodulaire, un défaut d'élasticité du cardia et
l'impossibilité de franchir la jonction oeso-gastrique(20) En cas de doute, un examen TDM et/ou une écho-endoscopie
permettent de visualiser l'infiltration tumorale sous-muqueuse de la paroi oesophagienne qui ne sera parfois confirmée que
par l'intervention chirurgicale, ce qui fut le cas deux fois sur 12 dans notre expérience (21).Quelques cas d'achalasie para-
néoplasique on été décrits.(22)
COMPLICATIONS
- Les complications respiratoiresaffectent 10 % des patients. Elles sont provoquées par l'aspiration trachéale. Il peut
s'agir de broncho-pneumopathies, d'abcès pulmonaires, d'aspiration à l'induction anesthésique qui doit être prévenue par
l'aspiration de la stase oesophagienne..
Mais le risque évolutif majeur est la survenue d'un carcinome épidermoïde de l'œsophage. Sa fréquence est estimée à
environ 5 % . Il survient en moyenne 17 ans après la date du diagnostic. Le pronostic du carcinome épidermoïde de
l'œsophage associé à l'achalasie est sévère et la survie au-delà de la découverte de la lésion n'excède pas quelques mois
(22) en raison de l'apparition tardive des signes cliniques. L'utilité d'une surveillance endoscopique après dilatation
pneumatique est controversée. L'association américaine d'endoscopie recommandait en 1988 de ne pas surveiller les
patients traités à un stade précoce efficacement.(22)
EVOLUTION CLINIQUE APRES TRAITEMENT
L'efficacité des traitements notamment instrumentaux a été évaluée selon une échelle clinique à 4 stades par Vantrappen
(23). (très bon résultat, bon , passable, echec) ou par un score composite selon Eckardt additionnant les scores de 0 à 3
pour dysphagie, douleur et régurgitations (24). Les 2 échelles ne sont pas du tout superposables. La présence de
régurgitations est considérée comme un échec dans la classification de Vantrappen.
Kim a rapporté une mauvaise corrélation entre les résultats cliniques et l'évaluation objective manométrique et radiologique
Black et al,1976
[6]
108
100
74
17
46
4,8 ans
Fellows et al,1986
[7]
63
100
79
56
79
4,5 ans
Dillipiani et al,1986
[8]
45
96
60
30
27
Howard et al,1992
[3]
38
10
57
70
1,7 ans
Eckardt et al,1997
[9]
87
99
85
65
77
24
4,7 ans
Série
personnelle,1995
237
98
81
76
43
22
6 ans
Référence
Nombre
demalades
Achalasie
(%)
Maladie desspasmes
diffus (%)
Anomalies non spécifiques (dont œsophage «
casse-noisettes »)(%)
Traube et al, 1983
[11]
112
12
10
-(12)
Benjamin et al,1983
[12]
34
0
0
>50(29)
Katz et al, 1987
[10]
910
0 ,7
3
25(13)
Hewson et al, 1991
[13]
100
0
4
28(6)

en utilisant un score composite (25). Nous avons à l'inverse trouvé une corrélation entre résultats cliniques et tests objectifs
avec le score de Vantrappen (26). Une absence de corrélation individuelle ( bon résultat clinique et mauvais résultat
radiologique ou scintigraphique ) était en rapport avec l'existence d'un méga-dolicho-oesphage ou d'un diverticule
épiphrenique ( 26).
Après traitement chirurgical, la survenue d'une dysphagie éloignée pose le problème de son mécanisme : myotomie
insuffisante avec récidive de l'achalasie, sténose fibreuse cicatricielle ou sténose peptique. La manométrie est souvent en
défaut pour le diagnostic précis de même que la fibroscopie s'il n'y a plus de signe de reflux. Une dilatation test avec une
bougie peut démontrer l'existence de la fibrose. Un test radiologique pharmacologique avec le dinitrate d'isosorbide, peut
être d'une grande aide au diagnostic : absence d'ouverture de la striction cardiale en cas de fibrose extrinsèque ou
peptique, ouverture significative ( plus de 4 mm de diamètre) en cas d'achalasie résiduelle (Fig 2). (27)
LA MALADIE DES SPASMES DIFFUS (MSD).
Ce syndrome est caractérisé par la perte intermittente du péristaltisme oesophagien. La MSD est cinq fois moins fréquente
que l'achalasie mais plus fréquente chez les malades explorés pour douleurs thoraciques à bilan cardiaque négatif. (10).
Elle survient chez des patients de plus de 50 ans. Le diagnostic repose sur un faisceau d'arguments cliniques, radiologiques
et manométriques.
HISTOPATHOLOGIE
Les signes histologiques sont non spécifiques. Il existe inconstamment un épaississement des couches musculaires qui peut
atteindre un centimètre. Il concerne surtout la couche circulaire, est fusiforme, s'étendant de la crosse de l'aorte à la région
sus-sphinctérienne. Une myomatose diffuse ou pseudo tumorale est parfois associée. Les cellules ganglionnaires des plexus
intra-pariétaux sont conservées au moins partiellement .La dénervation serait plus extrinsèque, vagale qu'intrinsèque. Elle
atteint préferentiellement comme l'achalasie la voie inhibitrice rendant compte de la perte intermittente du péristaltisme(28)
CLINIQUE
Une dysphagie pour les liquides et les solides associées à des douleurs thoraciques sont les symptômes habituels de la
maladie des spasmes diffus de l'oesophage (MSD).
La dysphagie est moins prononcée et plus intermittente et les douleurs sont plus importantes que dans l'achalasie. Le
retentissement des symptômes sur l'état général est moindre au cours de la MSD. L'amaigrissement est rare de même que
la stase oesophagienne et les régurgitations.
La douleur est intermittente et survient en dehors aussi fréquemment qu'à l'occasion des repas. Le stress ou les émotions
augmentent leur fréquence ; Le caractère de la douleur varie d'une douleur aiguë durant quelques secondes ou quelques
minutes à une douleur profonde prolongée et soutenue plusieurs heures notamment la nuit. Elle est rétrosternale plus
souvent basse que haute (29) et peut irradier du cou, aux épaules, au dos (en interscapulaire) mais aussi aux bras. Elle
peut être soulagée par les dérivés nitrés ou les inhibiteurs calciques mimant réellement un angor.La douleur est
inconstamment soulagée par l'ingestion de liquide. Elle peut être provoquée par l'ingestion d'eau froide.
la dysphagie est présente dans 50 à 80 % des cas (30, 31). Les douleurs isolées sont donc rencontrées dans 20 à 50 % des
cas. La dysphagie intermittente capricieuse est souvent douloureuse. Des douleurs violentes avec syncope à l'alimentation
ont été rapportées (30). La dysphagie se manifeste parfois, comme lors des sténoses fibreuses ou anneaux, par une
aphagie temporaire après l'ingestion brutale d'une grosse bouchée.
L'odynophagie, la douleur provoquée par l'alimentation, une gêne rétrosternale persistant dans l'intervalle des crises
douloureuses, sont des arguments pour l'origine oesophagienne de la douleur. Cependant une origine cardiaque doit être
éliminée par la coronarographie avant d'incriminer l'oesophage en l'absence de dysphagie.
EXAMENS COMPLEMENTAIRES
La fibroscopie peut évoquer le diagnostic devant un aspect tortueux ou en vrille de l'oesophage.Elle exclut un obstacle. Il
n'y a pas de stase alimentaire.
Certains aspects radiologiques ont été considérés comme évocateurs du diagnostic : spasmes segmentaires étagés,
aspect en tire-bouchon ou pseudo-diverticulaire. Parfois, le spasme se traduit par un rétrécissement de plusieurs
centimètres, axial, au 1/3 inférieur de l'œsophage. Mais la manométrie a considérablement restreint le rôle diagnostique de
la radiologie d'autant que ces anomalies peuvent être asymptomatiques.
L'écho-endoscopie est utile pour rechercher une hypertrophie musculaire oesophagienne, fréquente et apprécier son
extension en hauteur. Elle peut permettre de mieux définir l'extension en hauteur d'une myotomie étendue.(32)
La manométrie. Actuellement, le diagnostic de MSD est fondé, dans un contexte clinique évocateur, sur des anomalies
non équivoques en manométrie standard : ondes simultanées fréquentes (après plus de 30 % des déglutitions), amples ou
prolongées, avec ou sans activité spontanée, avec conservation partielle du péristaltisme, avec ou sans anomalie de
relaxation du SIO et une pression du SIO normale ou élevée. En manométrie-pH-métrie Holter, les symptômes sont
associés à la survenue d'ondes anormales, amples, prolongées et/ou répétitives, en l'absence de reflux. Cet examen
couplé permet de distinguer la véritable MSD des troubles moteurs associés au reflux gastro-oesophagien [30-34].
TRAITEMENT
La maladie des spasmes diffus requiert un traitement symptomatique par inhibiteurs calciques ou dérivés nitrés, à la
demande si les douleurs sont rares, ou avec une forme retard si les douleurs sont fréquentes. Les dilatations pneumatiques
sont utiles si une anomalie du SIO est associée ; les résultats sont moins bons que dans l'achalasie (23). Une myotomie
étendue peut être nécessaire dans les formes sévères invalidantes (32, 34).
FORMES INTERMEDIAIRES ET TROUBLES MOTEURS NON SPECIFIQUES
Des formes intermédiaires et des formes de passage de la MSD à l'achalasie permettent de parler de spectre des troubles
moteurs primitifs (35). Les troubles moteurs non spécifiques (oesophage casse-noisette, hypertonie du SIO) ne font pas
partie de ce spectre : les mécanismes en cause sont vraisemblablement différents (anomalies musculaires ou de la
commande cholinergique vagale) (36,37,38).
CONCLUSION :
L'achalasie peut amener à des complications graves. Le caractère insidieux ou trompeur des symptômes au début de
l'évolution peuvent égarer le clinicien. Une écoute attentive des patients doit permettre au praticien d'envisager le
diagnostic avant ou après la fibroscopie haute, examen princeps devant toute dysphagie, même ancienne, même
capricieuse. La MSD comme l'achalasie sera diagnostiquée grâce à la manométrie oesophagienne standard ou prolongée.
BIBLIOGRAPHIE
1. Kahrilas PJ. Esophageal motility disorders : pathogenesis, diagnosis, treatment. In : Champion MC, Orr WC (eds)
Evolving concepts in gastrointestinal motility. London, Blackwell Science 1996 : 15-45.

2. Metman EH, Lagasse JP, Picon L, Danquechin Dorval E,Goudeau A. Varicelle et achalasie primitive du sphincter inférieur
de l'oesophage. Gastroenterol Clin Biol 1996 ; 20 : 1138-9.
3. Howard P.J., Maher L., Pryde A., Cameron E.W.J., heading R.C. Five year prospective study of the incidence, clinical
features, and diagnosis of achalasia in Edinburgh. Gut 1992 ; 33:1011-5
4. Edwards DAW. Discriminatory value of symptoms in the differential diagnosis of dysphagia. Clinics in gastroenterology
1976 ; 5 : 49-57.
5. Vantrappen G, Hellemans J, Deloof W. Treatment of achalasia with pneumatic dilatation. Gut 1971 ; 12 : 268.
6. Black J, Vorbach AN, Collis JL. Results of Heller's operation for achalasia of the oesophagus. The importance of hiatal
repair. Br J Surg 1976 ; 63 : 949.
7. Fellows IW, Ogilvie AL, Atkinson M. Pneumatic dilatation in achalasia . Gut 1986 ; 24 : 1020.
8. Dellipiani AW, Hewetson KA. Pneumatic dialation in the management of achalasia : Experience of 45 cases. Q J Med
1986 ; 58 : 253.
9. Eckardt VF, Köhne U, Junginger T, Westermeir, Risk factors for diagnostic delay in achalasia : Dig Dis Sci 1997 ;42 : 580-
585
10. Katz P.O., Dalton CB, Richter JE. Esophageal testing of patients with non-cardiac chest pain or dysphagia. Ann Intern
Med 1987; 106: 593-7
11. Traube M, Albibi R, McCallum RW. High amplitude peristaltic esophageal contractions associated with chest pain. JAMA
1983 ; 250 :2655-2659.
12. Benjamin SB, Richter JE, Cordova CM, Knuff TE, Castell DO. Prospective manometric evaluation with pharmacologic
provocation of patients with esophageal motility dysfunction. Gastroenterology 1983 ; 84 : 893-901.
13. Hewson EG, Sinclair JW, Dalton CB, Richter JE. Twenty-four hour esophageal pH monitoring : the most useful test for
evaluating noncardiac chest pain. Am J Med 1991 ; 90 : 576-583.
14. Kahrilas PJ, Clouse RE, Hogan WJ. Policy and position statement . An american gastroenterological association medical
position statement on the clinical use of esophageal manometry. Gastroenterology 1994 ; 107 : 1865-1884.
15. Eckardt VF, Stauf B, Bernhard G. Cause and course of chest pain in patients with achalasia. Gastroenterology 1998 ;
114, 4 : A748
16. Spechler SJ, Souza RF, Rosenberg SJ, Ruben RA, Goyal RK. Heartburn in patients with achalasia. Gut 1995 ; 37 : 305-
308.
17. Crookes P.F., Corkill s., DeMeester T.R. Gastroesophageal reflux in Achalasia. When is reflux really reflux ? Dig Dis Sci
1997 ; 42 : 1354-61
18. Massey BT, Hogan WJ, Dodds WJ, Dantas RO. Alteration of the upper esophageal sphincter belch reflex in patients with
achalasia. Gastroenterology 1992 ; 103 :1574-9.
19. Parkman H.P., Maurer A.H., Caroline D.F., et al. Optimal evaluation of patients with nonobstructive esophageal
dysphagia. Manometry, scintigraphy, or videoesophagography ? Dig Dis Sci 1996 ; 41 : 1355-68
20. Kahrilas PJ, Kishk SM, Helm JF, Dodds WJ, Harig JM, Hogan WJ. Comparison of pseudoachalasia and achalasia. Am J
Med 1987 ; 82 :439-46.
21. Missonier F, Metman EH, Scotto B, Picon L. Critères diagnostiques de l'achalasie secondaire : à propos de 12 achalasies
secondaires tumorales. Gastroenterol Clin Biol 1994 ; 18 : A126
22. Reynolds JC , Parkman HP. Achalasia. Gastroenterol Clin North Am 1989 ; 18 : 222-55
23. Vantrappen G, Hellemans J. Treatment of achalasia and related motor disorders. Gastroenterology 1980 ; 79 : 144-54
24. Eckardt VF, Aignherr C, Bernhard G. Predictors of outcome in patients with achalasia treated by pneumatic dilation.
Gastroenterology 1992 ; 103 : 1732-8
25. Kim CH, Cameron AJ, Hsu JJ, Talley NJ, Trasteck VF et al. Achalasia : prospective evaluation of relationship between
lower esophageal transit, and esophageal diameter and symptoms in response to pneumatic dilatation. Mayo Clin Proc
1993 ; 68 : 1067-1073.
26. Metman EH, Picon L, d'Alteroche L. How can the frequent lack of correlation between clinical improvement and objective
measurements be explained ? in : The Esophagogastric junction. Giuli R, Ed, J. Libbey Paris-Londres 1998 : 1382-1384.
27. Metman EH, Scotto B, Picon L, Missonier F, Alison D. Test radiologiques au dinitrate isosorbide (DI) dans le diagnostic
positif et differentiel de l'achalasie idiopathique. Gastroenterol Clin Ciol 1994 ; 18 : A113.
28. Sifrim D, Janssens J, Vantrappen G. Failing deglutitive inhibition in primary esophageal motility disorders.
Gastroenterology 1994 ; 106 : 875-82.
29. Reidel WL, Clouse RE. Varations in clinical presentation of patients with esophageal contraction abnormalities. Dig Dis
Sci 1985 ; 30 : 1065-71. 15 30-
30. Vantrappen G., Hellemans J. Oesophageal spasm and other muscular dysfunction. Clinics in Gastroenterology
1982 ;11 : 453-77
31. Stein HJ, DeMeester TR. Indications, technique and clinical use of ambulatory 24-hour esophageal motility monitoring in
a surgical practive. Ann Surg 1993 ; 217 : 128-37
32. D'Alteroche L., Bourlier P., Picon L, Viguier J., Metman EH, Machet MC, De Calan L. Myotomie pour hypertrophie
musculaire avec infiltration à éosinophiles de l'oesophage associée à une toxocarose et révélée par un trouble moteur
oesophagien. Gastroenterol. Clin. Biol. 1998 ; 22 : 541-45
33. Barham CP, Gotley DC, Fowler A, Mills A, Alderson D. Diffuse oesophageal spasm : diagnosis by ambulatory 24 hour
manometry. Gut 1997 ; 41 : 151-5.Sci 1996 ; 41 : 1346-9
34. Allen M.l., Di Marino A.J. Manometric diagnosis of diffuse esophageal spasm. Dig Dis
35.Irving JD, Owen WJ, McCullagh M, Keighley A, Anggiansah A. Management of diffuse
esophageal spasm with baloon dilatation. Gastrointest Radiol 1992 ;17 :189-92
36.Eypasch E.P., De Meester T.R., Klingman R.R. et al. Physiologic assessment and surgical
management of diffuse esophageal spasm. J Thor Cardiov Surg 1992 ; 104 : 859-69
37.Vantrappen G, Janssens J, Hellemans J, Coremans G, Achalasia, diffuse esophageal spasm

AFC
Siège social : 122, rue de Rennes
75006 Paris
tél : +33 (0) 1 45 44 96 77
and related motility disorders. Gastroenterology 1979 ; 76 : 450-7
38.Leite LP, Johnston BT, Barrett J, Castell JA, Casttell DO. Ineffective osophageal motility
(IEM). The primary finding in patients with nonspecific esophageal motility disorder.
Digestive Diseases ans Sciences 1997 ; 42 : 1859-65
39.Hsu JJ, O'Connor MK, Kang YW, Kim CH. Nonspecific motor disorder of the esophagus :
a real disorder or a manometric curiosity ? Gastroenterology 1993 ; 104 : 1281-4
1
/
5
100%