Livre MAPAR 2003

MAPAR 2003
76
COMMENT JE TRAITE UNE ARYTHMIE ?
I. Philip, S. Provenchère, P. Sakr.
Département d’Anesthésie-Réanimation, Hôpital Bichat, 47, rue Henri Huchard,
75018 Paris. [email protected]
INTRODUCTION
La bonne prise en charge des arythmies par l’anesthésiste-réanimateur, au bloc
opératoire, en postopératoire ou en réanimation impose la connaissance d’un certain
nombre d’éléments simples (physiologiques, cardiologiques et pharmacologiques) qui
feront l’objet de ce chapitre.
1. ÉLECTROPHYSIOLOGIE : CE QU’IL FAUT SAVOIR
1.1. ÉLECTROPHYSIOLOGIE
Le couplage excitation-contraction est la base de la physiologie cardiaque. Les cellules
myocardiques sont excitables, un stimulus approprié pouvant entraîner une modication
des propriétés de la membrane, à l’origine d’un ux transmembranaire d’ions qui peut
à son tour être responsable du «potentiel d’action». Les modications des ux trans-
membranaires sont liées à des systèmes de pompes et de canaux (sodiques, calciques,
potassiques) (Figure 1).
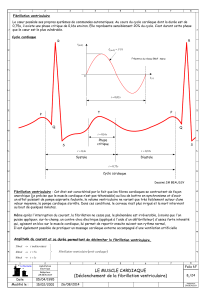
Figure 1 : Représentation simpliée d’un potentiel d’action au niveau d’une cellule
myocardique avec les principaux mouvements ioniques. Phase 0 : dépolarisation
rapide ; phase 1 : repolarisation rapide ; phase 2 : repolarisation lente en plateau ;
phase 3 : n de la repolarisation ; phase 4 : diastole : potentiel de repos.
mV
Na+
K+
3
2
1
0
4
-100
0
Intra-celulaire
MEMBRANE
Extra-cellulaire
Na+
ATP
K+
Ca+

MAPAR 2003
78
Questions pour un champion en anesthésie 79
Si chaque structure cardiaque possède des propriétés spéciques, on peut néanmoins
distinguer deux grands types de cellules (Figure 2, a et b):
• Les cellules non douées d’automatisme (myocarde contractile auriculaire et ventri-
culaire). Elles n’ont pas de dépolarisation diastolique lente ; la phase 0 est rapide,
dépendante des canaux sodiques et le plateau du potentiel d’action est prolongé,
permettant une entrée importante de calcium.
• Les cellules douées d’automatisme (nœud sinusal, nœud auriculo-ventri-culaire (NAV),
faisceau de His-Purkinje). Elles ont une dépolarisation diastolique lente, une pente de
dépolarisation de la phase 0 lente, dépendante des canaux calciques.
Ainsi, chaque tissu a des caractéristiques électriques propres qui expliquent d’une part
la physiologie, et d’autre part la physiopathologie (arythmies, troubles de conduction, et
mécanismes d’actions des antiarythmiques).
En pratique donc, l’automatisme est le fait des cellules du nœud sinusal (qui ont
l’automaticité la plus élevée), la conduction est plus lente dans les cellules nodales (NAV)
où la vitesse de dépolarisation de phase 0 est basse (rôle de ltre du NAV). A l’opposé,
dans le faisceau de His-Purkinje, la conduction est très rapide, assurant normalement une
activation synchrone des deux ventricules. Les variations du tonus sympathique et/ou
parasympathique modient de façon importante l’électrophysiologie ; elles participent
largement dans la genèse des troubles du rythme. Elles doivent donc être prises en compte,
notamment dans la phase péri-opératoire.
Figure 2 a : potentiel d’action d’une cellule myocardique contractile (non douée
d’automatisme), à réponse (conduction) rapide.
0
Na
Ca Ca
-80
Na
K
K
K
Na
Ca KNa
Ca
Na
K
Figure 2 b : potentiel d’action d’une cellule myocardique douée d’automatisme, à
réponse (conduction) lente.
mV
0
4
3
0
2
4
-60

MAPAR 2003
78
Questions pour un champion en anesthésie 79
Les mécanismes responsables des arythmies cardiaques peuvent être classés en deux
grandes catégories : anomalies de la genèse de l’inux (automatisme anormal et post-
potentiels, précoces ou tardifs), anomalies de la conduction de l’inux (phénomènes de
réentrée).
1.2. ANTI-ARYTHMIQUES
Il est classique de séparer les médicaments anti-arythmiques en fonction de leur action
préférentielle sur les canaux ioniques. Cette classication (Tableau I) apparaît simpliée,
car certaines substances ont plusieurs mécanismes d’action (l’amiodarone en particulier).
Néanmoins, elle permet de comprendre et de prévoir l’efcacité des molécules sur les
différents troubles du rythme [1].
Tableau I
Récepteur cible médicaments
Classe (Signes ECG)
Canaux Na et K IA (allongement QRS et QT) (Amiodarone)
Canaux Na IB
II (allongement R) Esmolol, propranolol, aténolol,
sotalol, (amiodarone)
Canaux K III (allongement QT)
Amiodarone
Sotalol
Bretylium
Canaux Ca IV (± allongement PR) Vérapamil
Diltiazem, (amiodarone)
Il est également possible d’utiliser (en cas de TSV) la Striadyne® (triphosadénine, les
américains utilisant l’adénosine) qui hyperpolarise le tissu nodal (en activant des canaux
potassiques) et provoque un bloc auriculo-ventriculaire du troisième degré transitoire.
La réponse est variable :
• Arrêt de la TSV en cas de tachycardie avec réentrée nodale ou avec un faisceau ac-
cessoire
• Ralentissement (transitoire) de la réponse ventriculaire en cas de brillation, de utter
auriculaire ou de tachycardie atriale focale (Tableau II), ce qui facilite le diagnostic.
• Réponse variable dans les autres tachycardies jonctionnelles.
Néanmoins, l’utilisation de la Striadyne® doit être prudente, compte tenu des effets
secondaires possibles.
Les antiarythmiques de classe I ont actuellement peu d’indications ; il est recommandé
de les arrêter en préopératoire. En dehors de la lidocaïne, ils ont très peu de place en
aigu, surtout en péri-opératoire.
Pour la pratique (cf infra), on peut retenir que l’amiodarone présente un certain
nombre d’avantages dans le contexte péri-opératoire et en réanimation : elle est active
aux deux étages (ventriculaire et auriculaire), elle a moins d’effets secondaires en aigu
que les autres anti-arythmiques, elle a un effet bénéque en cas de brillation ventricu-
laire et /ou d’arrêt cardiaque extra-hospitalier [2-4]. L’administration d’amiodarone par
voie intraveineuse (ou orale mais récente) a, essentiellement un effet d’inhibition des
courants potassiques, avec un risque mineur d’interférence avec les agents d’anesthésie.
A l’opposé une prise chronique chez des patients ayant une cardiopathie évoluée peut
être délétère lors de l’anesthésie. Néanmoins, compte tenu de sa longue demi-vie
d’élimination (plusieurs semaines), le sevrage préopératoire de l’amiodarone est dif-
cilement envisageable. De nouvelles molécules dérivées de l’amiodarone devraient être

MAPAR 2003
80
Questions pour un champion en anesthésie 81
bientôt disponibles : la dronédarone (dérivé non iodé) et le E 047/1 (métabolite actif de
courte durée d’action, à l’opposé de l’amiodarone) [5, 6].
Tableau II
Principaux troubles du rythme
Troubles du rythme supraventriculaires
Tachycardie sinusale
Extrasystole auriculaire
Fibrillation auriculaire
Tachycardie atriale
• Flutter (macroréentrée)
• TA réentrantes
• TA focales
Tachycardie jonctionnelle
• Focales (exceptionnelles)
• Rythmes réciproques nodaux
• Rythmes réciproques utilisant une voie accessoire
Troubles du rythme ventriculaires
• Extrasystole ventriculaire
• Tachycardie ventriculaire (> 3 ESV consécutives)
• Rythme idioventriculaire accéléré
• Fibrillation ventriculaire
Enn, il faut citer le sulfate de magnésium dont l’injection intra-veineuse peut être active
par de multiples mécanismes [7] : classe IV principalement mais aussi classe I, etc…
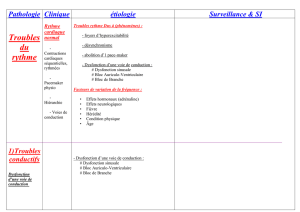
2. LES DIFFÉRENTS TROUBLES DU RYTHME
2.1. LES MÉCANISMES
Schématiquement, trois mécanismes sont possibles pour les différents troubles du
rythme [8, 9] :
2.1.1. L’AUTOMATISME ANORMAL
Il survient soit lors d’une ischémie ou d’une anoxie, soit lors de certaines modications
ioniques (hyperkaliémie par exemple) ou d’une augmentation des catécholamines. Il est
secondaire soit à une élévation de la pente de dépolarisation de la phase 4 (catécholamines)
soit à un déplacement du potentiel de repos vers des valeurs moins négatives.
2.1.2. LES POST-POTENTIELS
Les postpotentiels, précoces ou tardifs, peuvent engendrer des activités auto-
déclenchées. Les premiers se voient surtout au niveau des bres de Purkinje dans certaines
conditions pathologiques (ischémie, dyskaliémie, étirement ...) et sont favorisés par les
anti-arythmiques. Les seconds sont favorisés par les tachycardies, les catécholamines
et les digitaliques.
2.1.3. LES RÉENTRÉES
Elles apparaissent quand un trouble de conduction ralentit le passage de l’inux
dans une voie, alors qu’il se fait normalement dans les tissus adjacents ; l’inux va

MAPAR 2003
80
Questions pour un champion en anesthésie 81
alors remonter «à contre-sens» dans la voie initialement bloquée, créant une boucle
avec possibilité de déclenchement d’une tachycardie. Il peut s’agir de macroréentrée
ou de microréentrée.
Il convient de mettre à part la torsade de pointes, qui est favorisée par un allongement
de l’intervalle QT acquis ou congénital, mais aussi par la bradycardie, l’hypokaliémie,
l’hypomagnésémie et certains antiarythmiques. Le mécanisme initiateur de l’arythmie
est vraisemblablement l’automatisme déclenché (post-potentiels précoces). Le diagnostic
n’est pas toujours aisé dans la mesure où l’aspect est voisin d’une TV mais il existe un
changement progressif de l’axe de QRS autour de la ligne iso-électrique.
2.2. LES TROUBLES DU RYTHME
Ils sont rappelés dans le tableau II.
3. TROUBLES DU RYTHME ET PÉRIODE PÉRI-OPÉRATOIRE
3.1. INCIDENCE
L’incidence des troubles du rythme rapportée dans la littérature, pendant la phase
périopératoire, dépend de plusieurs facteurs [9-11] :
• Du type de surveillance utilisée, continue ou non [10].
• De l’existence ou non de cardiopathies sous-jacentes
• Enfin du type de chirurgie. Les chirurgies cardiaques, pulmonaires ou même
œsophagiennes (lors du temps thoracique) sont celles qui s’accompagnent le plus
fréquemment de ces complications [12-15].
Haering et al. ont colligé les complications cardiaques péri-opératoires survenant chez
77 patients ayant une cardiomyopathie hypertrophique à prédominance septale, opérés
de chirurgie non cardiaque [16]. Chez un quart des patients, un trouble du rythme, bien
supporté, va survenir. Un seul patient va faire une tachycardie ventriculaire, contemporaine
d’un infarctus péri-opératoire, qui nécessitera une cardioversion en urgence.
Un autre exemple, plus fréquent celui-là, est celui de la prise en charge des patients
ayant un prolapsus de la valve mitrale. Les sujets les plus à risque de troubles du rythme,
notamment ventriculaires, sont les plus âgés, ceux ayant une fuite mitrale signicative, et
ceux ayant une dilatation de l’oreillette et du ventricule gauches [17]. Chez les nombreux
sujets ayant simplement un click télésystolique, avec ou sans anomalies de la repolarisa-
tion sur l’ECG de base, il ne semble pas que la fréquence des troubles du rythme soient
accrue. Par contre, il est recommandé de s’assurer de l’absence de désordres ioniques
associés. Les patients recevant des ß-bloquants au long cours doivent continuer leur
traitement. La digoxine doit être évitée dans le traitement des arythmies chez ces patients
car elle est susceptible d’engendrer des arythmies ventriculaires.
La dysplasie ventriculaire droite arythmogène est une maladie familiale beaucoup
plus rare (de l’ordre de 1 pour 10 000). Elle peut être suspectée en péri-opératoire
devant la survenue de trouble du rythme ventriculaire sévère chez un sujet jusqu’alors
asymptomatique. En cas de maladie connue, la prise en charge fait appel, en prévention,
à l’utilisation de l’amiodarone ou de bêta bloquants.
En ce qui concerne le type de chirurgie, il est fréquent d’observer des TSV après
chirurgie pulmonaire [12]. La survenue d’une telle complication est associée à une
morbidité et une mortalité plus élevées et un allongement de la durée d’hospitali-
sation [12, 14, 15]. En chirurgie cardiaque (et aussi thoracique), de nombreux troubles
du rythme surviennent pendant le geste chirurgical : ils sont volontiers déclenchés par
les manipulations du chirurgien et sont donc souvent brefs et résolutifs sans traitement.
Après chirurgie cardiaque, de nombreux facteurs expliquent la fréquence des arythmies
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%