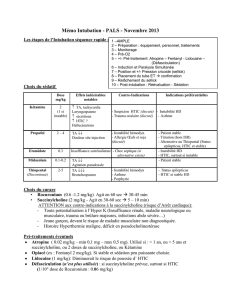
Curarisation prolongée après injection de succinylcholine sur déficit

Journal Identification = ABC Article Identification = 0865 Date: July 18, 2013 Time: 10:51 am
doi:10.1684/abc.2013.0865
485
Pour citer cet article : Huynh-Moynot S, Moynot JC, Thill C, Commandeur D, Ould-Ahmed M, Drouillard I. Curarisation prolongée après injection de succinylcholine sur
déficit congénital en butyrylcholinestérase et potentialisée par un traitement au lithium : à propos d’un cas. Ann Biol Clin 2013 ; 71(4) : 485-8 doi:10.1684/abc.2013.0865
Biologie au quotidien
Ann Biol Clin 2013 ; 71 (4) : 485-8
Curarisation prolongée après injection
de succinylcholine sur déficit congénital
en butyrylcholinestérase et potentialisée
par un traitement au lithium:àpropos d’un cas
Prolonged curarisation following succinylcholine injection
on butyrylcholinesterase deficiency and potentiated
by a lithium treatment: a case report
Sophie Huynh-Moynot1
Jean-Clair Moynot2
Chloé Thill1
Diane Commandeur1
Mehdi Ould-Ahmed1
Isabelle Drouillard3
1Fédération d’anesthésie, réanimation
et des urgences, Hôpital d’instruction
des armées Clermont-Tonnerre, Brest,
France
2Fédération de chirurgie, Hôpital
d’instruction des armées
Clermont-Tonnerre, Brest, France
3Fédération des laboratoires, Hôpital
d’instruction des armées
Clermont-Tonnerre, Brest, France
Article rec¸u le 7 septembre 2012,
accept´
e le 13 septembre 2012
Résumé. La succinylcholine est un curare de courte durée d’action dont la
dégradation dépend de son hydrolyse rapide par la butyrylcholinestérase (ou
pseudocholinestérase). Ainsi, un déficit en butyrylcholinestérase, congénital
ou acquis, est à l’origine d’un bloc neuromusculaire prolongé. De transmission
autosomique récessive, le déficit génétique reste la première étiologie. Le variant
atypique est le plus fréquemment retrouvé et est à l’origine d’une curarisation
prolongée de 2 heures après injection de succinylcholine. Nous présentons le
cas d’un patient qui, après l’injection de succinylcholine, a présenté un retard de
décurarisation lié à un déficit congénital en butyrylcholinestérase et favorisé par
un traitement au lithium. L’extubation n’a été possible que 7 h après l’injection
du curare.
Mots clés : butyrylcholinestérase, lithium, pseudocholinestérase, sévoflurane,
succinylcholine, syndrome paranéoplasique
Abstract. Succinylcholine is a short-term curare which degradation depends on
its quick hydrolysis by butyrylcholinesterase (or pseudocholinesterase). Thus,
a butyrycholinesterase deficiency, congenital or acquired, is a cause of a pro-
longed neuromuscular block. From an autosomal recessive inheritance, genetic
deficiency remains the first etiology. The most frequently discussed variant is
the atypical variant which caused a 2 hours prolonged curarisation after adminis-
tration of succinylcholine. We report a patient who had a prolonged curarisation
after succinylcholine’s injection, due to a congenital butyrylcholinestérase defi-
ciency and contributed by a lithium treatment. Extubation was only possible 7
hours after administration of curare.
Key words: butyrylcholinesterase, pseudocholinesterase, lithium, sevoflurane,
paraneoplastic syndrome
Nous rapportons le cas d’un déficit en butyrylcholinesté-
rase congénital potentialisé par un traitement au lithium,
découvert lors d’un bloc neuromusculaire prolongé après
injection de succinylcholine.
L’observation
Monsieur C., âgé de 65 ans, est un patient hospitalisé en psy-
chiatrie pour altération de l’état général dans un contexte
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

Journal Identification = ABC Article Identification = 0865 Date: July 18, 2013 Time: 10:51 am
486 Ann Biol Clin, vol. 71, n◦4, juillet-août 2013
Biologie au quotidien
de déséquilibre de sa psychose maniacodépressive.
Dans ses autres antécédents, il est noté une extraction
dentaire 15 ans auparavant sous anesthésie générale. Son
traitement habituel comprend de la fluoxétine, du lithium,
du valproate de sodium, de l’oxazépam, de la pipam-
pérone et de la cyamézanine. Dans le bilan étiologique
de l’altération de l’état général, il bénéficie d’un scanner
thoraco-abdominopelvien mettant en évidence des adé-
nopathies médiastinales. L’indication d’une fibroscopie
bronchique à la recherche de lésions en faveur d’un can-
cer bronchopulmonaire est posée. Une anesthésie générale
avec intubation orotrachéale est choisie compte tenu de
l’antécédent psychiatrique. Le patient pèse 52 kg pour
1,70 m. L’induction est réalisée par propofol (20 mg) et
suxaméthonium (100 mg) ; l’entretien de la sédation par
sévoflurane. La durée de la fibroscopie bronchique est de
25 min. Cette dernière est sans particularité, hormis une sur-
élévation régulière blanchâtre de la muqueuse de la bronche
souche gauche faisant réaliser des biopsies systématiques.
À la fin du geste, la sédation est arrêtée puis le patient
est transféré en salle de surveillance post-interventionnelle.
L’évolution est marquée par la persistance d’un coma
et l’absence de déclenchement du respirateur, tandis que
l’hémodynamique reste stable. Le monitorage de la cura-
risation par le « train of four » (TOF : mesure au niveau
de l’adducteur du pouce du rapport entre la réponse de
la 4estimulation et de la 1re stimulation, après 4 stimu-
lations brèves d’une durée de 0,2 ms, répartie sur 2 s)
indique une curarisation profonde avec un TOF à 0 sur une
échelle de 4. La mesure de la glycémie capillaire ne retrouve
pas d’hypoglycémie. Une tentative d’antagonisation par
anéxate, naloxone et prostigmine s’avère sans effet. Trois
heures plus tard, le TOF est mesuré à 2 sur 4, puis à 4
sur4àla4
eheure. Un bilan étiologique du coma est réa-
lisé mais il reviendra ultérieurement normal : lithiémie à
0,53 mmol/L (0,6-1,2), taux de TSH, T3L et T4L respec-
tivement à 1,62 mUI/L (0,27-0,42), 5,53 pmol/L (3,1-6,8)
et 14,23 pmol/L (13-23), taux de valproate de sodium à
77 mg/L (50-100), recherche d’antidépresseurs tricycliques
négative, alcoolémie à 0 g/L. Le patient est transféré intubé
et sédaté par propofol dans le service de réanimation dans
l’attente d’une décurarisation complète. Un bilan complé-
mentaire à l’admission (bilan hépatique, troponine et bilan
rénal) s’avère normal. Après vérification de l’absence de
curarisation résiduelle, la sédation est arrêtée 7 h après la
fibroscopie bronchique. Le patient est extubé sans compli-
cations. Un prélèvement sanguin sur tube sec à la recherche
d’un déficit congénital ou acquis en butyrylcholinestérase
plasmatique est réalisé. Ce dernier reviendra ultérieurement
et confirmera un déficit quantitatif (butyrylcholinestérase
plasmatique à 3 003 UI/L pour une norme entre 4 200 et
13 000 UI/L). Par ailleurs, la recherche par biologie molé-
culaire retrouve une mutation de cette enzyme à l’état
homozygote du variant atypique. L’évolution globalement
favorable permet le retour du patient dans le service de
psychiatrie dès le lendemain.
Le point de vue du biologiste
La cholinestérase est une enzyme catalysant l’hydrolyse
de l’acétylcholine en acétate et en choline. On distingue
deux types de cholinestérases par leur origine, leur struc-
ture, leur spécificité d’action et l’indication de la mesure de
leur activité [1].
L’acétylcholinestérase (cholinestérase globulaire ou choli-
nestérase vraie car intracellulaire) a une affinité presque
exclusivement spécifique pour son substrat naturel,
l’acétylcholine. Elle est synthétisée dans le globule rouge
et le tissu nerveux. Son rôle physiologique est d’assurer
le fonctionnement des synapses acétylcholinergiques de
la jonction neuromusculaire en évitant l’accumulation de
l’acétylcholine. Elle est également présente dans les pou-
mons et la rate [1].
La butyrylcholinestérase (cholinestérase sérique ou pseu-
docholinestérase car extracellulaire ou BchE en abréviation
internationale) a une affinité beaucoup plus large. Elle
hydrolyse de nombreux esters synthétiques et naturels,
dont l’acétylcholine. Elle est présente dans le plasma, le
foie (siège de sa synthèse), le pancréas et l’intestin [1].
Néanmoins, son rôle physiologique demeure incertain :
elle pourrait participer à l’hydrolyse du neurotransmetteur
pendant la différenciation cellulaire au cours du dévelop-
pement embryonnaire, à la transmission nerveuse lente
ou encore à la régulation de la concentration plasmatique
de la choline [1, 2]. Le dosage de la butyrylcholinesté-
rase est réalisé grâce à une technique colorimétrique qui
mesure la cinétique d’hydrolyse à l’aide d’un substrat, la
butyrylthiocholine [1]. Les valeurs usuelles de la butyryl-
cholinestérase varient selon l’âge, le sexe et la concentration
d’œstrogènes/progestérone (grossesse, prise de contracep-
tifs oraux) [1, 3]. La mesure de son activité enzymatique
est indiquée dans l’intoxication aiguë ou l’exposition chro-
nique aux produits organophosphorés, l’évaluation d’une
insuffisance hépatocellulaire et la recherche d’une anomalie
de production qualitative se traduisant par une curarisation
prolongée. La mesure de l’activité de l’acétylcholinestérase
confirme également les cas d’intoxications aiguës ou chro-
niques aux organophosphorés. Cette dernière est aussi
présente dans le liquide amniotique au cours d’un défaut
de fermeture du tube neural [1].
La curarisation prolongée après administration d’une dose
usuelle de succinylcholine a été décrite pour la première fois
en 1953 [3]. Il existe de nombreuses étiologies expliquant
un déficit en butyrylcholinestérase, congénital ou acquis
(tableau 1). Cependant, le déficit enzymatique d’origine
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

Journal Identification = ABC Article Identification = 0865 Date: July 18, 2013 Time: 10:51 am
Ann Biol Clin, vol. 71, n◦4, juillet-août 2013 487
Succinylcholine et déficit en butyrylcholinestérase
Tableau 1. Facteurs modifiant l’activité de la butyrylcholinestérase
[1, 4].
Augmentation Diminution
Hyperlipoprotéinémie
Diabète sucré
Obésité
Thyréotoxicose
Goitre nodulaire
Hypertension essentielle
Asthme
Psoriasis
Schizophrénie
Alcoolisme
État anxieux
Atteintes hépatiques sévères
Néoplasie, carcinome
Atteinte rénale sévère
Plasmaphérèse, circulation
extracorporelle
Sepsis
Brûlure
Tétanos
Maladie du collagène
Rhumatismes articulaires
Maladie inflammatoire
Typhus
Infarctus du myocarde
Myxœdème
Anémie
Malnutrition
Maladie chronique débilitante
Épilepsie
Médicaments : lithium, IMAO,
chlorpromazine,
pancuronium, anesthésiques
locaux à fonction ester,
anticholinestérasiques
(néostigmine, pyridostigmine,
physostigmine),
cyclophosphamide, fluorures
(enflurane, sévoflurane),
bambutérol, propanidide
Toxiques :
organophosphorés,
moutardes azotées
Radiothérapie
génétique reste la principale cause. Sa transmission est
autosomique récessive de fac¸on variable. Le gène de la buty-
rylcholinestérase est situé sur le chromosome 3 [3]. Il existe
de nombreux variants, le plus fréquent étant le variant aty-
pique. Généralement, 1 individu sur 25 à 50 se trouve à
l’état hétérozygote tandis qu’il faut compter 1 individu sur
3 000 pour l’état homozygote [4].
Dans le cas clinique présenté, d’autres étiologies acquises
peuvent être évoquées compte tenu du déficit modéré en
butyrylcholinestérase, des antécédents du patient et de son
traitement. En effet, le lithium et le sévoflurane allongent la
durée de curarisation par les curares dépolarisants tels que
la succinylcholine [2, 5]. Près de 90 % de la succinylcho-
line est hydrolysée par la butyrylcholinestérase. La durée
habituelle du bloc moteur, inversement proportionnelle à
l’activité de l’enzyme, est de 10 min [3]. En cas d’activité
pseudocholinestérasique réduite, la durée observée de cura-
risation est de2henmoyenne [4]. C’est surtout le variant
silencieux, plus rare (1/100 000), qui est responsable d’une
durée de curarisation supérieureà4h[4]. Bien que le déficit
génétique ait été mis en évidence, le traitement par lithium
et l’entretien de la sédation ont potentialisé la durée du bloc
neuromusculaire.
Néanmoins, une étude récente montre que l’activité pseudo-
cholinestérasique est plus élevée chez les patients bipolaires
de type 1 et chez les patients sous antipsychotiques [6].
Le point de vue du clinicien
Dans le cadre du bilan étiologique de ce bloc neuromus-
culaire prolongé, certaines causes acquises ont pu être
facilement éliminées par les tests biologiques courants :
thyréotoxicose, alcoolisation, hyperglycémie, infarctus du
myocarde, insuffisance hépato-cellulaire et insuffisance
rénale. Des déficits acquis peuvent en effet coexister avec
un déficit congénital en butyrylcholinestérase.
La suspicion d’un syndrome paranéoplasique reste plau-
sible dans l’observation présentée en raison de l’altération
de l’état général du patient et des adénopathies médias-
tinales suspectes retrouvées au scanner. Les carcinomes
abaissent l’activité de la butyrylcholinestérase. Le degré de
dépression est influencé par l’extension néoplasique et le
site de la lésion primitive, même en l’absence d’altération
de la fonction hépatique. Les tumeurs mammaires ont moins
d’effets que les tumeurs pulmonaires, gastro-intestinales
ou génito-urinaires. L’explication repose sur la production
d’inhibiteurs de la butyrylcholinestérase dans certains types
de cancers [2].
La posologie de succinylcholine administrée dans
l’observation présentée, supérieure à la dose théorique de
1 mg/kg, a également favorisé la prolongation du bloc
neuromusculaire. Quant à l’administration de prostigmine,
elle est formellement contre-indiquée car elle inhibe non
seulement l’acétylcholinestérase, mais aussi la butyrylcho-
linestérase [3].
La récupération d’un bloc neuromusculaire prolongé secon-
daire à un déficit en butyrylcholinestérase peut être
accélérée par l’administration titrée de butyrylcholinesté-
rase plasmatique d’origine humaine [2]. Les principaux
inconvénients de cette préparation sont son coût élevé et
le risque infectieux notamment viral, bien que les produits
soient pasteurisés [2]. Néanmoins, le meilleur traitement
reste l’attente d’une décurarisation spontanée [7, 8].
Les nombreuses observations rapportées dans la littérature
sur les cas de curarisation prolongée soulèvent le problème
de l’innocuité de l’utilisation d’un curare métabolisé par
les pseudocholinestérases (succinylcholine et mivacurium)
et celui de la prévention d’un tel accident. Cependant, le
dépistage préopératoire systématique d’un déficit en pseu-
docholinestérase ne s’impose pas car la fréquence des
sujets homozygotes déficitaires est très faible. En revanche,
l’interrogatoire pré-anesthesique doit rechercher systéma-
tiquement des antécédents personnels ou familiaux de
curarisation prolongée. Le monitorage de la fonction mus-
culaire est indispensable [2]. La connaissance par le patient
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

Journal Identification = ABC Article Identification = 0865 Date: July 18, 2013 Time: 10:51 am
488 Ann Biol Clin, vol. 71, n◦4, juillet-août 2013
Biologie au quotidien
de son déficit enzymatique est impérative pour prévenir un
accident ultérieur en cas d’anesthésie générale. Un pro-
tocole intrahospitalier de prise en charge du déficit en
pseudocholinestérase, de la présomption du diagnostic à
sa confirmation, est recommandé. Il en existe un exem-
plaire sur internet [9]. Une information précise est à fournir
dans tous les cas, au patient et à sa famille, sur les consé-
quences de l’utilisation d’un médicament métabolisé par
la butyrylcholinestérase. Un document ou une carte écrite
précisant la nature du déficit doit être fourni aux sujets à
risque. Tout nouveau cas de curarisation prolongée avec un
myorelaxant doit faire l’objet d’une déclaration au centre
de la pharmacovigilance [2].
Conclusion
Un déficit en butyrylcholinestérase d’origine génétique
reste la première cause de bloc neuromusculaire prolongé
après injection de succinylcholine, mais il peut coexister
avec des déficits acquis. L’originalité de ce cas réside dans
le fait que le bloc neuromusculaire, bien que secondaire à un
déficit congénital en butyrylcholinestérase à l’état homozy-
gote, était potentialisé par un traitement au lithium et possi-
blement par un syndrome paranéoplasique sous-jacent. Par
ailleurs, le respect systématique de la dose de succinylcho-
line de 1 mg/kg aurait permis d’écourter l’allongement de la
curarisation. Enfin, la prostigmine est formellement contre-
indiquée en cas de déficit en butyrylcholinestérase ; cette
connaissance doit être appliquée dès la constatation d’une
curarisation prolongée à la succinylcholine.
Liens d’intérêts : aucun.
Références
1. Laboratoire Pasteur Cerba. Guides des analyses spécialisées. Paris :
Elsevier, 2007 : 281.
2. Lejus C. Les cholinestérases. Ann Fr Anesth Réanim 1998 ; 17 : 1122-
35.
3. Lejus C, Delaroche O, Trille E, Blanloeil Y, Pinaud M. Butyrylcholi-
nesterase deficiency : how to analyse the cholinesterase activity in small
children ? Ann Fr Anest Réanim 2006 ; 25 : 657-60.
4. Flanna K, Soliday FK, Conley YP, Henker R. Pseudocholinesterase
deficiency : a comprehensive review of genetic, acquired, and drug
influences. AANA Journal 2010 ; 78 : 313-21.
5. Gomez F, Cantini O, Valat P, Usandizaga D, Reynier P, Janvier G,
et al. Anesthésie pour électroconvulsothérapie. Ann Fr Anest Réanim
2001 ; 20 : 187-95.
6. Ezzaher A, Haj Mouhamed D, Mechri A, Neffati F, Douki W, Gaha
L, et al. Etude de l’activité pseudocholinestérasique chez des patients
bipolaires de type 1. Ann Biol Clin 2012 ; 70 : 25-31.
7. Ceppa F, Kenane N, Chellak S, Bigaillon C, Burnat P. Prolon-
ged succinylcholine-induced apnoea associated with cholinesterase silent
plasma variant. Ann Fr Anest Réanim 2005 ; 24 : 425-7.
8. Chemchik H, Souii S, Naija W, Bouzouita O, Ben Selma A, Said R. Pro-
longed neuromuscular block following celocurin injection : a case report.
Rev Anest Réa Med Urg 2011;3:12-4.
9. Service d’anesthésie-réanimation du Centre Hospitalier Intercommu-
nal de Poissy St Germain. Déficit en pseudocholinestérase plamastique : du
diagnostic présomptif à la confirmation. http://anesth-chips.fr/protocoles-
d-anesthesie/chirurgie-generale/article/deficit-en-pseudocholineterase,
mai 2012.
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.
1
/
4
100%