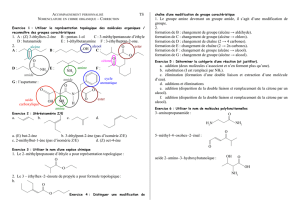
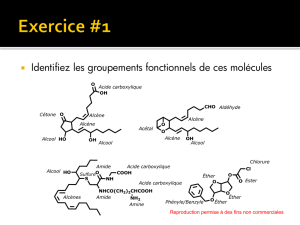
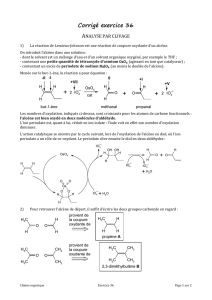
Correction TP23

Correction TP23:
1. Écrire l’équation de la réaction en utilisant les formules semi-développées des molécules. Identifier, par une couleur, les atomes
de la molécule d’alcool perdus au cours de la réaction. Justifier alors le titre de ce TP.
C’est bien une déshydratation puisqu’une molécule d’eau est formée.
2. Légender le schéma dans le document n°2.
3. Pourquoi l’erlenmeyer est-il placé dans un bain d’eau glacée ?
L’alcène ayant une température d’ébullition assez faible, il faut le refroidir pour être sûr de ne pas perdre de produit.
4. Pourquoi chauffe-t-on le mélange réactionnel ?
Le chauffage permet d’accélérer la réaction et permet de faire par distillation la séparation du produit de synthèse.
5. Quel est le rôle de l’acide phosphorique dans cette expérience ? le rôle de la pierre ponce ?
L’acide phosphorique est un catalyseur pour la réaction. La pierre ponce permet d’agiter le système chimique et d’homogénéiser le
milieu réactionnel.
6. Schématiser l’ampoule à décanter avec les phases aqueuse et organique et justifier la position respective de ces phases.
7. Pourquoi ajoute-t-on la solution d’hydrogénocarbonate de sodium ? Ecrire la réaction.
L’hydrogénocarbonate de sodium permet d’introduire une base qui va neutraliser l’acide qui catalysait la réaction (H3PO4): les ions
ne se dissolvent dans l’eau et être évacués dans la phase aqueuse. Le CO2 est éliminé par dégagement gazeux.
L’équation de réaction est : HCO3 (aq) + H3O+ (aq) → 2H2O (l) + CO2 (g)
8. Le sulfate de magnésium anhydre permet de sécher la phase organique grâce à la réaction d’équation :
MgSO4(s) + 7H2O(l) →MgSO4,7H2O(s). Expliquer ce que cela signifie et la nécessité de cette étape dans le protocole.
Le sulfate de magnésium anhydre peut capter 7 molécules d'eau pour former du sulfate de magnésium heptahydraté. De pH
neutre avec une vitesse de séchage rapide, il est utilisé pour éliminer les traces d'eau des liquides organiques.
Pour effectuer le séchage, ajouter du sulfate de magnésium anhydre sous forme de poudre jusqu'à ce que les grains ne
s'agglomèrent plus entre eux. (On doit voir une pluie de particules au-dessus et pas un paquet au fond). Effectuer ensuite une
filtration pour récupérer le composé sec.
Thermomètre
Erlenmeyer
Hydrodistillat
Colonne Vigreux
Ballon
Chauffe ballon
Support élévateur
La phase aqueuse est en dessous car la
densité de l’eau est supérieure à la densité
de l’alcène.
Réfrigérant

9. Calculer la quantité initiale d’alcool, notée n(ol), utilisée lors de l’expérience.
On a ajouté 20 mL d’alcool donc
0,183mol
88,1
0,805x20
M
dxV
M
m
n(ol)
10. Quelle masse maximale d’alcène, notée mmax, peut-on obtenir ?
D’après la réaction chimique on peut obtenir autant de mole d’alcène que de mole d’alcool ayant réagi soit au maximum
0,183 mole d’alcène soit m=0,183xM=12,8 g
11. Définir le rendement η de la réaction, l’exprimer en fonction des masses mmax et mexp puis le calculer.
On a pesé 6,6 g d’alcène : le rendement est
%51514,0
1,70183,0 6,6
max
exp
m
m
12. Que permet de vérifier le spectre infrarouge de l’hydro distillat obtenu ?
On voit sur le spectre infra- rouge que la fonction OH n’est plus présente et que la double liaison apparait : l’alcool a donc
bien réagit et n’est plus présent dans l’hydrodistillat.
13. En utilisant l’un des trois termes « addition », « substitution » ou « élimination », rédiger une phrase décrivant la nature de la
réaction de synthèse. La réaction de synthèse est une réaction d’élimination puisqu’il y a formation d’une double liaison.
14. Vérifier, expérimentalement, que l’espèce constituant l’hydrodistillat comporte bien une double liaison C = C. En utilisant l’un des
trois termes « addition », « substitution » ou « élimination », rédiger une phrase décrivant la nature de la réaction et écrire son
équation en utilisant les formules semi-développées. On fait le test à l’eau de brome et on remarque qu’il est positif : l’alcène est
donc bien présent. Il s’agit d’une réaction d’addition puisque la double liaison dans l’alcène « disparait » :
15. Quel isomère peut se former en petite quantité lors de la déshydratation ? (nom et formule). Si vous deviez isoler les 2 produits,
comment procéderiez-vous ?
On peut aussi former du méthyl-2 but-1-ène : de formule
Pour isoler les 2 produits, il faudrait faire une nouvelle distillation, mais l’écart de température d’ébullition étant faible, la
manipulation risque d’être délicate (Teb=31,2° pour le méthyl-2 but-1-ène contre 38,2°)
1
/
2
100%