La diversité des phénotypes

(1 semaine)
L
La diversité des phénotypes
a diversité des phénotypes
Introduction :
●Les caractères individuels sont le résultat de l'expression du programme génétique et de
l'influence des conditions de vie.
●Les chromosomes sont constitués chacun d'une molécule d'ADN qui contient des gènes.
●Les molécules d'ADN de tous les individus ont la même structure, mais les séquences
nucléotidiques varient.
●Des modifications aléatoires de la séquence d'ADN déterminent l'apparition de mutations
à l'origine des allèles.
●La présence d'allèles différents au sein d'une même espèce conduit à la diversité de ses
individus.
1
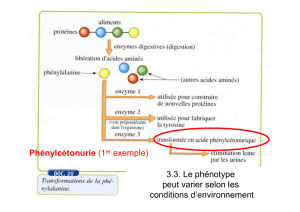
1 Le phénotype à différentes échelles.
Le phénotype à différentes échelles.
Le phénotype est défini par des caractères anatomiques (couleur des yeux, des cheveux, taille) ou par
l'état physiologique (malade ou en bonne santé) résultant de l'expression des gènes.
La drépanocytose : un phénotype pathologique (
Pages 14 à 17
).
1.1
1.1 À l'échelle macroscopique.
À l'échelle macroscopique.
L'individu atteint présente les symptômes d'une anémie chronique (fatigue, diminution du nombre
d'hématies) ainsi que des complications diverses (infarctus, insuffisance rénale, respiratoire). Ces
symptômes caractérisent le phénotype drépanocytaire.
1.2
1.2 À l'échelle microscopique ou cellulaire.
À l'échelle microscopique ou cellulaire.
Normalement, les hématies sont des disques biconcaves et déformables qui peuvent circuler
facilement dans les capillaires sanguins et apporter le dioxygène aux différents tissus de l'organisme.
Chez l'individu drépanocytaires, les hématies deviennent rigides et prennent une forme en faucille non
déformable (hématies falciformes). Elles obstruent ainsi les capillaires sanguins.
Les tissus sont donc mal irrigués et les échanges respiratoires sont perturbés.
La destruction de ces hématies est à l'origine de l'anémie.
1.3
1.3 À l'échelle moléculaire.
À l'échelle moléculaire.
Document 3 page 17
Les hématies de l'individu non atteint contiennent de nombreuses molécules d'hémoglobine dites HbA
qui sont toujours solubles, tandis que celles de l'individu drépanocytaire contiennent des molécules
d'hémoglobine dites HbS qui, lorsqu'elles sont désoxygénées, polymérisent et forment des fibres. Les
hématies deviennent alors rigides et indéformables.
1.4
1.4 Conclusion.
Conclusion.
La polymérisation des molécules de HbS (phénotype moléculaire) détermine la formation de
fibres déformant les hématies qui deviennent falciformes (phénotype cellulaire). Les hématies
falciformes bouchent les capillaires sanguins, cela provoque des accidents circulatoires
(phénotype macroscopique).
Remarque : on dit que la drépanocytose est un phénotype alternatif car il s'agit de variations
observées pour un même caractère dans une population d'individus de la même espèce.
Quelle l'origine des phénotypes alternatifs ?
1

2
2 L'origine des phénotypes alternatifs.
L'origine des phénotypes alternatifs.
Comment les gènes peuvent-ils déterminer les phénotypes ?
2.1
2.1 Des protéines interviennent dans la réalisation des phénotypes
Des protéines interviennent dans la réalisation des phénotypes
alternatifs.
alternatifs.
2.1.1
2.1.1 Les protéines sont à l'origine du phénotype.
Les protéines sont à l'origine du phénotype.
TP : La drépanocytose.
L'hémoglobine est constituées de deux chaînes α et de deux chaînes β.
Chez l'individu atteint de drépanocytose (
Document 3 page 17
), l'acide glutamique (Glu) est remplacé
par la valine (Val) en position 6 de la chaîne β. La protéine de l'hémoglobine est donc modifiée. C'est ce
qui provoque la formation de fibres rigides d'hémoglobine HbS.
Les propriétés d'un polypeptide dépendent donc de sa séquence d'acides aminés.
Remarque : peptide = acide aminé, polypeptide = protéine.
2.1.2
2.1.2 La configuration spatiale des protéines détermine leur propriétés.
La configuration spatiale des protéines détermine leur propriétés.
Les protéines constituées de chaînes d'acides aminés de longueur variable acquièrent leur structure
spatiale par des liaisons à faible énergie, établies entre les radicaux latéraux de certains acides aminés.
C'est la séquence des acides aminés qui impose la forme qu'adopte la molécule. Toute modification de
cette séquence peut se traduire par un changement de la configuration spatiale et donc de la propriété
de la protéine.
2.2
2.2 Les mutations des gènes sont à l'origine des phénotypes alternatifs.
Les mutations des gènes sont à l'origine des phénotypes alternatifs.
2.2.1
2.2.1 Les gènes contrôlent La synthèse des protéines.
Les gènes contrôlent La synthèse des protéines.
Document 3 page 17
Un gène gouverne la synthèse de la chaîne α et un autre gène intervient dans la synthèse de la chaîne
β. La comparaison des deux hémoglobines HbA et HbS montre que seule la chaîne β est modifiée chez les
individus drépanocytaires.
2.2.2
2.2.2 L'apparition des phénotypes alternatifs.
L'apparition des phénotypes alternatifs.
Dans le cas de la chaîne β de l'hémoglobine drépanocytaire, il y a substitution d'une base azotée
adénine (A) par une autre base azotée thymine (T) du sixième codon (CAG remplacé par CTG). Une
modification de la séquence des nucléotides de la molécule d'ADN modifie donc la séquence d'acides
aminés de la protéine produite. Cela conduit à la formation d'un nouvel allèle.
Remarque : cette mutation s'est produite vraisemblablement plusieurs fois dans l'histoire de
l'humanité, ce qui permet de mieux comprendre la répartition actuelle de la drépanocytose qui ne serait
pas due à de simples phénomènes migratoires.
2.3
2.3 Conclusion.
Conclusion.
Au cours des temps géologiques, les séquences des gènes ont subi des mutations qui ont
déterminé l'apparition de nouvelles versions des gènes, les allèles. Ces allèles commandent la
synthèse de polypeptides différents, ce qui explique l'existence de phénotypes alternatifs liés
au même caractère.
Ce sont donc les différentes formes d'allèles d'un gène s'exprimant à travers la diversité des
protéines qui sont responsables des phénotypes alternatifs.
Les modifications affectant une ou plusieurs protéines expliquent la réalisation des
phénotypes alternatifs.
2
1
/
2
100%