Les marqueurs biologiques de souffrance cardiaque

Les marqueurs biologiques de
souffrance cardiaque
DCEM 1
Octobre 2010
Dr Bafghi-Caruba Céline
Laboratoire de Biochimie - CHU Nice

Les maladies cardiovasculaires
䌤㻃Une des premières causes de mortalité dans les pays industrialisés
(incidence = 165/100 000 personnes)
䌤㻃Source de recrutement importante pour les services des urgences
䌤㻃Deux pathologies différentes :
- Cardiopathies ischémiques
- angor stable
- angor instable
- infarctus du myocarde
- Insuffisance cardiaque

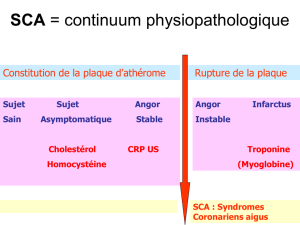
Les cardiopathies ischémiques

䌤㻃Evolution lente
䌤㻃Alternances de phases de stabilité et d’instabilité
䌤㻃A partir de la rupture de la plaque d’athérome peu sténosante (90 %)
䌤㻃Autres mécanismes (plus rares) : spasmes coronariens, embolie
coronaire, dissection coronaire

La plaque d’athérome
· Début de la formation de la plaque : dépôt de graisse et de cholestérol
· Des cellules musculaires entourent ce dépôt
䚍㻃épaississement de la plaque et rétrécissement ou « sténose »
· A partir de la rupture de la plaque d’athérome
- Mise à nu de la matrice sous-endothéliale
- Adhésion, activation et agrégation plaquettaire
- Diminution des apports en oxygène et en substrats au
niveau du myocarde
Si la thrombose est non occlusive angor instable
Si la thrombose devient totalement occlusive IDM
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
1
/
56
100%