COLLE PC CHIMIE n°8 du 21/11 au 26/11 CHIMIE ORGANIQUE

COLLE PC CHIMIE n°8 du 21/11 au 26/11
CHIMIE ORGANIQUE :
Création de liaisons C-C : réactivité nucléophile des énolates
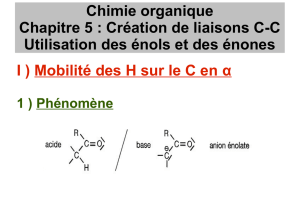
Acidité d’un composé carbonylé :
─ Écrire la formule de la base conjuguée d’un composé carbonylé énolisable et justifier sa stabilité à
l’aide du formalisme de la mésomérie.
─ Généralisation aux composés analogues (esters, dicétones, cétoesters).
─ Ordres de grandeur des pKa des couples correspondants.
─ Proposer ou justifier le choix d’une base permettant de déprotoner un composé carbonylé ou un
composé analogue.
C-alkylation en position alpha d’un groupe carbonyle de cétone :
─ mécanisme limite, régiosélectivité de l’alkylation des énolates : Justifier la réactivité nucléophile
ambidente de l’énolate dans le formalisme de la mésomérie ou par l’analyse de ses orbitales
frontalières.
─ Décrire les interactions entre orbitales frontalières des réactifs et interpréter la régiosélectivité de
l’alkylation de l’énolate.
Aldolisation non dirigée : mécanisme en milieu basique aqueux.
Aldolisation (cétolisation) croisée dirigée avec déprotonation totale préalable :
mécanisme, intérêt synthétique. Savoir choisir dans le cadre d’une stratégie de synthèse les meilleures
conditions de préparation d’un aldol (cétol) issu d’une aldolisation (cétolisation) croisée.
Crotonisation : déshydratation de l’aldol (cétol) en présence d’une base, mécanisme E1cb, régiosélectivité.
Révision de la déshydratation en milieu acide des alcools
Analyse rétrosynthétique Identifier dans une analyse rétrosynthétique les composés carbonylés ayant
conduit à un aldol (ou cétol) ainsi qu'à une crotone.
Réaction de Michael sur une α-énone ;
─ mécanisme. Décrire les interactions entre orbitales frontalières des réactifs et
interpréter la régiosélectivité de la réaction de Michael.
─ Analyse rétrosynthétique : Identifier dans une analyse rétrosynthétique les réactifs permettant
de réaliser une addition de Michael sur une alpha-énone.
THERMO second principe :
Second principe. Enthalpie libre. Identités thermodynamiques pour U, H et G
potentiel chimique : expression du potentiel chimique dans des cas modèles de : gaz parfaits ; constituants
condensés en mélange idéal ; solutés infiniment dilués.
Révisions de SUP PCSI - réactions d’oxydo-réduction cf programme précédent
1
/
1
100%