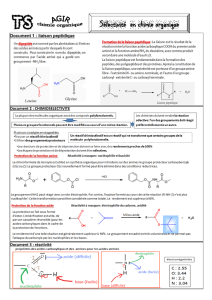
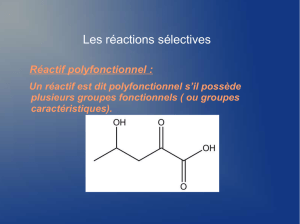
A- Formation de la liaison peptidique

A- Formation de la liaison peptidique
Un peptide : combinaison de 2 ou plusieurs AA par des
liaisons amides particulières = liaisons peptidiques
Liaison peptidique
Chaîne peptidique :( réaction positive au Biuret)
O
Nt Ct


C
N
O
H
Chaîne polypeptidique.
C
R1
H
H2N
CC
R2
H
C
N
O
H
CC
R3
H
CCOOH
R4
H
N
O
H
O
N
H
La chaîne polypeptidique apparaît comme une succession de motifs
«liaison peptidique » appelée squelette polypeptidique, sur laquelle
sont greffées les chaînes latérales des acides aminés.
Motif de la liaison peptidique:

B- Structure de la chaîne peptidique
Le placement des Radicaux d’AA sur les Cαn’est possible que dans la
configuration trans.
Configuration Trans de 2
résidus successifs

Rotation de 2 liaisons peptidiques successives autour d’un même atome de Cα
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
1
/
18
100%