La sélectivité en chimie organique

Cours TS Chimie
La sélectivité en chimie organique
Notions du programme mises en jeu :
-Extraire et exploiter des informations :
-sur l'utilisation de réactifs chimiosélectifs,
-sur la protection d’une fonction dans le cas de la synthèse peptidique, pour mettre en évidence le
caractère sélectif ou non d’une réaction.
Documents d’études :
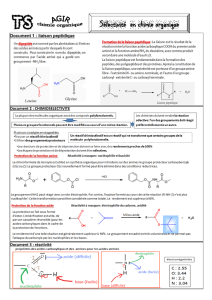
Document n°1 :
Document n°2 :
Document n°3 : Electronégativité :
𝜒(O) > 𝜒(N) > 𝜒(C) ≃ 𝜒(H).

Document n°4 : Synthèse du dipeptide Ala-Gly à partir de l’Alanine et de la Glycine.
Questions :
Nous allons étudier la synthèse d’un dipeptide (leu-gly) à partir des acides animes suivants : glycine (gly)
et leucine (leu). En fin de réaction, on analyse le milieu réactionnel en couplant plusieurs techniques
d’analyses comme la RMN, l’électrophorèse et la chromatographie sur couche mince. Ces analyses révèlent
notamment que trois autres dipeptides de nature différente sont formés en plus de Leu-Gly initialement
souhaité.
1) Quels sont les groupes caractéristiques présents dans un acide α-aminé ? Groupe Carboxyle : fonction
acide carboxylique / Groupe amine : fonction amine.
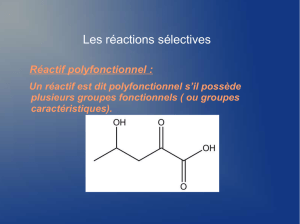
2) Les 2 acides aminés, la glycine et la leucine, sont-ils des composes polyfonctionnels ? Ecrire les 4
équations-bilan permettant d’obtenir les 4 dipeptides (Leu-Gly, Leu-Leu, Gly-Leu, Gly-Gly). Quelle
fonction chimique porte la liaison peptidique ?

3) La réaction entre le Leucine et la glycine est non sélective. Justifier cette affirmation.
Elle est non sélective car tous les sites de la leucine régissent avec tous les sites de la glycine, il y a
donc formation de 4 dipeptides.
4) Voici l’écriture simplifiée du mécanisme de formation de la liaison peptidique dans le cas du dipeptide
Leu-Gly:
A l’aide de flèches
courbées, représenter le
mécanisme réactionnel
ayant eu lieu dans ce
cas.
5) Repérer les fonctions qu’il va falloir protéger sur les 2 acides α-aminés si l’on veut obtenir le dipeptide
Leu-Gly uniquement. Il faut protéger les fonctions acide de la glycine et Amine de la leucine.
Etude dans le détail de la formation du dipeptide Ala-Gly
6) Équilibrer la première étape de la synthèse présentée au document n°4. Justifier l'intérêt d'un milieu
basique pour réaliser cette étape. Il faut rajouter HCl dans les produits. Le milieu basique est
indispensable pour empécher la fonction acide carboxylique de réagir.
7) Pour former le dipeptide Ala-Gly, une des deux fonctions de l'alanine ne doit pas réagir. Laquelle ? On
dit qu'il faut la protéger (Protection de fonction).
Dans quelle étape de la synthèse cette protection est-elle réalisée ? L’étape n°1 afin de protéger la fonction
Amine.
8) A quoi sert la dernière étape de la synthèse ? A la libérée.
9) De même, il faudrait a priori protéger l'une des deux fonctions de la glycine. Laquelle ? Ceci est-il
effectué dans la synthèse ? La fonction acide.
10) En réalité, les fonctions acide carboxylique sont assez peu réactives. Plutôt que de protéger celle qui ne
doit pas réagir, on préfère activer celle qui doit réagir (Activation de fonction).
Dans quelle étape de la synthèse cela est-il réalisé ? Etape n°3
Quelle est la nouvelle fonction chimique synthétisée ? La liaison peptidique.

Dans la troisième étape de la synthèse, la création de la liaison peptidique a
lieu. Voici l'écriture simplifiée du mécanisme de cette réaction :
11) Indiquer les sites donneurs et accepteurs d'électrons que l'on trouve sur les réactifs dans la première étape
de ce mécanisme. Sites Donneurs Sites accepteurs
12) Pour chaque étape, représenter par une (ou des) flèche(s) courbe(s) les déplacements électroniques qui
ont lieu entre ces sites.
13) Préciser la nature (addition, élimination ou substitution) des réactions qui ont lieu lors des étapes 1 et 2.
Addition puis élimination.
1
/
4
100%