Estérification : exercice

Estérification :
exercice
I. Enoncé
!"
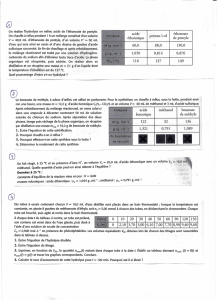
Données
Composés Masse molaire
(g/mol) Masse volumique
à 20°C (g/mL) Solubilité
dans l’eau
Acide benzoïque 122 1,3
Peu
soluble
Méthanol (vapeurs
toxiques) 32 0,8 Soluble
Benzoate de
méthyle 136 1,1 Insoluble
I – Le benzoate de méthyle est obtenu par une réaction d’estérification
entre l’acide benzoïque de formule C
6
H
5
COOH et le méthanol de
formule CH
3
OH en présence d’acide sulfurique.
1. Ecrire l’équation-bilan de la réaction et donner ses
caractéristiques.
2. Quel est le rôle de l’acide sulfurique ?
II – Dans un ballon on introduit 12,2 g d’acide benzoïque, 40 mL de
méthanol, 3 mL d’acide sulfurique concentré et quelques grains de
pierre ponce. On réalise un montage à reflux sous la hotte et on
chauffe doucement pendant une heure.
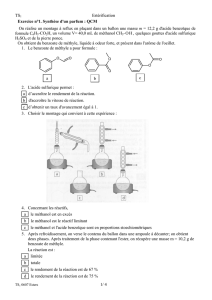
1. a. Parmi les montages représentés ci-après, quel est celui qui
convient pour réaliser un montage à reflux ? Justifier votre
choix.
b. Pourquoi chauffe-t-on ? Quelle est l’utilité du montage à
reflux ?
2. a. Déterminer la quantité de matière initiale en méthanol, puis
en acide benzoïque.
b. Montrer que l’on utilise un excès de méthanol. Quel est le
but recherché ?
III – Après refroidissement on verse le contenu du ballon dans une
ampoule à décanter contenant 50 mL d’eau distillée froide. On obtient
deux phases différentes.
Après traitement de la phase contenant l’ester, on récupère une masse
m = 10,2 g de benzoate de méthyle.
1. Dessiner l’ampoule à décanter ; indiquer la place respective
des deux phases et préciser leur contenu.
2. a. Quelle serait la masse d’ester m0 obtenue si la réaction
était totale.
b. Calculer le rendement de la réaction.
II. Corrigé
I – 1. C6H5COOH + CH3OH C6H5COOCH3 + H2O
Cette réaction, comme toutes les réactions d’estérification à partir
d’acide carboxylique, est lente, athermique et limitée (2/3).
2. L’acide sulfurique joue le rôle de catalyseur (il accélère la
réaction).
II – 1. a. Le montage C est le bon montage pour effectuer un
chauffage à reflux. En effet : le montage A est un montage à
distiller (le constituant le plus volatil peut s’échapper car le
réfrigérant est incliné), le montage B ne permet pas de
condenser les éventuelles vapeurs se formant lors du
chauffage (comme le méthanol) et dans le montage D le sens
de circulation de l’eau froide dans le réfrigérant n’est pas
correct.
b. Le chauffage permet d’accélérer la réaction. Le reflux
permet de récupérer les espèces chimiques se vaporisant.
2 - a. n ( méthanol ) = m ( méthanol )
M ( méthanol )
m ( méthanol ) = ! x V = 0,8 x 40 = 32 g
donc n ( méthanol ) = 32
32 = 1,0 mole.
n ( acide ) = m ( acide )
M ( acide ) = 12,2
122 = 0,10 mol
b. En observant l’équation-bilan, on remarque que tous les
coefficients sont égaux à 1 donc le mélange initial est
équimolaire. Or n (méthanol) = 10 x n (acide) donc le
méthanol est en large excès.
c. Le fait que l’un des deux réactifs soit en excès va permettre
de déplacer l’équilibre chimique vers la droite et donc
d’augmenter le rendement de la réaction.
III – 1.
Le benzoate de méthyle est la seule espèce chimique insoluble
dans l’eau : elle constituera la phase organique. De plus, sa
densité est supérieure à 1, cette phase sera donc située en
dessous.
2. a. Pour calculer la masse d’ester formé, il faut se baser sur le
réactif limitant. De plus pour une mole d’acide consommée, une
mole d’ester est formée donc si la réaction était totale :
n (ester formé) = n (acide consommé)
n (ester formé) = 0,10 mol
m (ester formé) = n (ester formé) x M (ester formé)
= 0,10 x 136
Donc m (ester formé) = 13,6 g
b.
rendement = masse de produit réellement obtenu
masse de produit obtenu si la réaction était totale
rendement = 10,2
13,6 = 0,75
MemoPage.com SA © / 2006 / Auteur : Emmanuel Parras
1
/
1
100%