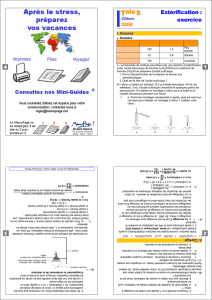
60,0 88,0 130,0 1050 0814 0876 118 137 149 -` -----+------.,

On réalise l'hydrolyse en milieu acide de l'éthanoate de pentyle.
On chauffe àreflux pendant 1 h un mélange constitué d'un volume
V
=
40,0 ml d'éthanoate de pentyle, d'un volume V'
=
50 ml
d'eau qui sera ainsi en excès et d'une dizaine de gouttes d'acide
sulfurique concentré. Enfin de chauffage et après refroidissement,
le mélange réactionnel est traité par une solution d'hydrogéno-
carbonate de sodium afin d'éliminer toute trace d'acide; lé3phase
organique est récupérée, puis séchée. On' -réali~~~lors sa
distillation et on récupère une masse m
=
7,1 g d'un liquide dont
la température d'ébullition est de
Ù7 "C,
Quel pourcentage d'ester a-t-on -hydrolysé?
acide pentan-J-ol éthanoate
éthanoïque de pentyle
60,0 88,0 130,0
1,050 0,814 0,876
118 137 149
GD. ,
le benzoate de méthyle,
à
odeur d'œillet, est utilisé en parfumerie. Pour le synthétiser, on chauffe
à
reflux, sous la hotte, pendant envi-j
ron une heure, une masse m
=
12,2 g d'acide benzoïque C6HS- C0
2
H, et un volume;
V
=
49 ml de méthanol et
3
ml d'acide sulfurique. ,
Après refroidissement du mélange réactionnel, on verse celui-ci acide méthanol benzoate
dans .une ampoule
à
décan~er conte~ant. 50 m.l de solution benzoïque de méthyle
saturee de chlorure de sodium. Apres separation des deux -'
-----+------.,...-+---,---;.....:...--1
phases, lavage puis séchage de la phase organique, on récupère
par distillation une masse mexp
=
10,2 g de benzoate de méthyle.
1.
Écrire l'équation de cette estérification.
2.
Pourquoi chauffe-t-on
à
reflux?
3.
Pourquoi effectue-t-on cette synthèse sous la hotte?
4. Déterminer le rendement de cette synthèse
32 136
122
0,791 1,089
1,321
••••
On fait réagir,
à
25°C et en--;'résence d'ions H+,un volume
Va
=
20,0 ml d'acide éthanoïque avec un volume
Ym
~:]l~?"±
méthanol. Quelle quantité d'ester peut-on ainsi obtenir
à
l'équilibre? ..... ' ~,',
Données à 25°C:
constante d'équilibre de la réaction mise en jeu:
K
=
4,00 . 1
masses volumiques: acide éthanoïque :
!la
=
1,044 g. mL-
1;
méthanol:
!lm
=
0,791 g. ml- .
Dixtubes
à
essais contenant chacun
v:
=
10,0 ml d'eau distillée sont placés dans un bain thermostaté ; lorsque la température est
constante, on ajoute
8
gouttes de méthanoate d'éthyle, soit
no
=
5,00 mmol
à
chacun des tubes,en déclenchant le chronomètre. Chaque
tube est bouché, puis agité et remis dans le bain thermostaté.
À
chaque date tdu tableau ci-contre, un tube est prélevé,
son contenu est versé dans de l'eau glacée, puis dosé
à
l'aide .d'une solution de soude de concentration
C
B
~8;500 mol.L:' en présence de phénolphtaléine. les volumes équivalents
V
BE
obtenus lorsde chacun des titrages sont rassemblés
dans le tableau ci-dessus.
1.
Écrirel'équation de l'hydrolyse étudiée.
2.
Écrirel'équation du titrage.
3. Exprimer, en fonction de
V
BE,
la quantité
nesterCt)
restant dans chaque tube àla date
t.
Établir un tableau donnant
nacide
Ct)
=
(Ct)
et
nester(t)
=
g(t)
et tracer les graphes correspondants. Conclure.
4. Calculer le taux d'avancement de cette hydrolyse pour t
=
120 min. Pourquoi est-il si élevé?
o
10 20 30 40 50 60 90 120 150
o
2,10 3,70 5,00 6,10 7,00 7,70 8,90 9,40 9,60
1
/
1
100%