d`après bac Liban 2014 ex 3 : Quelques alcools de l`industrie

d’après bac Liban 2014
ex 3 : Quelques alcools de l’industrie chimique
Le méthanol est un liquide incolore et inflammable ; il est miscible à l’eau, aux alcools, aux esters
et à la plupart des autres solvants organiques. Pour produire du méthanol, l’hydrogénation du
dioxyde de carbone est la voie la plus étudiée actuellement. Ce procédé peut être modélisé par la
réaction chimique dont l’équation est :
CO2 + 3H2 méthanol + H2O
Le méthanol intervient par exemple dans la production du formaldéhyde, de l’acide acétique ou
encore du MTBE (2-méthoxy-2-méthylpropane), lequel est un adjuvant des carburants. Dans de
moindres volumes, le méthanol est utilisé dans les piles à combustible DMFC (Direct Methanol
Fuel Cell) ou encore dans le traitement des eaux usées.
(a) CH3OH -> CO2
1.3. équilibrer la demi-équation électronique (a) ci-dessus, le méthanol intervient-il en tant
qu’oxydant ou en tant que réducteur ? Justifier votre réponse.
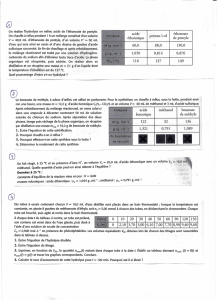
1.1. Le tableau nous montre que l’électronégativité du carbone et de l’hydrogène sont proches, ainsi les liaisons C –
H ne sont pas polarisées.
Par contre comme
(C) <
(O), la liaison C–O est polarisée. Il apparaît une charge partielle négative sur l’atome O
et une charge partielle positive sur l’atome C.
De même comme
(H) <
(O), la liaison O–H est polarisée.
Représentons la molécule de méthanol avec la représentation de CRAM et avec ses charges partielles.
Il apparaît que le centre géométrique des charges partielles positives n’est pas confondu avec celui des charges
négatives, alors la molécule de méthanol est polaire.
1.2. L’équation (a) correspond à la réaction utilisée dans la pile à combustible présentée sur le document 2.
L’équation (b) correspond à la production de l’acide acétique CH3CO2H évoquée en fin de document 1.
1.3. La demi-équation (a) est du type Réd = Ox + n e–. Elle décrit l’oxydation du réducteur CH3OH qui libère 6
électrons. Le méthanol est un réducteur.
δ+
δ+
δ–
1
/
1
100%