Mise au point en médecine cardiovasculaire L`amylose cardiaque à

12:48:15:04:13
Page 183
Page 183
Mise au point en médecine cardiovasculaire
L’amylose cardiaque à transthyrétine (TTR)
Frederick L. Ruberg, MD ; John L. Berk, MD
Les amyloses systémiques forment un groupe d’affections
secondaires à des erreurs de plissement ou d’assemblage
de diverses protéines. Le dépôt extracellulaire de ces protéines
sous forme de feuillets anti-parallèles β-plissés, solubles ou
insolubles, perturbe le fonctionnement des organes vitaux.1
Plus de 27 pré-protéines différentes sont à même de constituer
des fibrilles amyloïdes.2 A chacune de ces pré-protéines dont le
plissement anormal donne naissance à des fibrilles amyloïdes
correspondent un type d’amyloïde et une évolution clinique
particulière de la maladie. Plusieurs variétés d’amyloïdes
peuvent infiltrer le cœur, provoquant une dysfonction
diastolique et systolique progressive, une insuffisance car-
diaque congestive et le décès du patient. Le traitement de
l’amylose cardiaque est conditionné par le type d’amyloïde en
cause et par l’importance des dépôts. Un dépistage précoce et
un étiquetage précis sont donc deux éléments essentiels.3
Le diagnostic de l’amylose repose sur l’identification
histologique des dépôts amyloïdes. Le rouge Congo les colore
en rose saumoné en microscopie optique, alors qu’en lumière
polarisée ils présentent une biréfringence vert pomme
caractéristique (Figure 1). L’application d’une coloration
immunohistochimique spécifique des pré-protéines permet
d’établir à quel type appartient l’amyloïde (Figure 2).4 Ce sont
toutefois la microscopie électronique avec immunomarquage
à l’or colloïdal et la spectrométrie de masse qui font preuve
des meilleures sensibilité et spécificité en matière de typage des
amyloïdes.5,6
Deux types d’amyloïdes infiltrent couramment le cœur :
(1) la protéine constituée d’une chaîne légère d’immuno-
globuline (amyloïde AL ou systémique primitive) et (2) la
protéine appelée transthyrétine (TTR). Les amyloses à trans-
thyrétine se répartissent elles-mêmes en deux variétés : une
forme familiale résultant du plissement incorrect d’une
TTR ayant subi une mutation (cardiomyopathie amyloïde
familiale ou polyneuropathie amyloïde familiale [PAF]) et une
forme sporadique, d’origine non génétique, provoquée par
l’agrégation anormale d’une transthyrétine de type sauvage
(amylose systémique sénile [ASS]). Une amylose cardiaque
peut également être causée par d’autres pré-protéines telles
que l’apolipoprotéine A1, mais il s’agit d’une forme dont la
prévalence est faible et qui sort du cadre de cette mise au
point.3 En revanche, l’incidence de l’amylose AL est estimée
de l’ordre de 2 500 nouveaux cas par an,7 dont près de
la moitié comporterait une participation cardiaque.8–10 En
l’absence de traitement, le pronostic de l’amylose AL est
sombre, la survie médiane après diagnostic étant inférieure
à un an lorsqu’il existe des symptômes d’insuffisance
cardiaque.8 Contrairement à l’amylose cardiaque de type AL,
la cardiomyopathie amyloïde à transthyrétine est d’évolution
lente et cliniquement bien tolérée, de sorte que le diag-
nostic n’est souvent porté qu’en présence d’un important
épaississement des parois ventriculaires, d’une dysfonction
diastolique majeure et de troubles de la conduction. Non
traités, les patients atteints d’amylose cardiaque à trans-
thyrétine peuvent vivre des années, voire plusieurs décennies.
L’amylose secondaire ou de type AA résulte du plissement
incorrect de l’amyloïde A, un marqueur sérique de phase
aiguë de l’inflammation chronique. Les examens écho-
cardiographiques pratiqués dans trois études chez, respec-
tivement, 48, 30 et 224 patients atteints d’amylose AA ont mis
en évidence des signes caractéristiques de cardiomyopathie
amyloïde chez seulement 1,3 % des sujets de la cohorte totale,
une insuffisance cardiaque congestive avérée ayant été
observée chez moins de 1 % d’entre eux.1–13 Bien que des
signes histologiques d’amyloïde cardiaque soient présents
chez 30 % des patients finlandais atteints de polyarthrite
rhumatoïde, l’insuffisance cardiaque est rare au sein de cette
population.14 Ces données montrent que le myocarde et les
voies de conduction ne sont que rarement le siège de dépôts
d’amyloïde AA ayant un retentissement clinique significatif
et que l’infiltration des artères coronaires est peu fréquente.15
La TTR, autrefois appelée préalbumine, est une protéine
de transport de 56 kDa, constituée de 127 acides aminés et
qui est principalement exprimée par le foie. Normalement,
la TTR circule sous la forme d’un homotétramère, mais,
sous l’effet de mutations génétiques ou du vieillissement,
les tétramères peuvent se scinder en monomères dont
l’assemblage incorrect aboutit à la formation de fibrilles
amyloïdes.16 Comme il existe deux formes d’amyloses à TTR
(l’une liée à l’âge, encore appelée amylose sénile [TTR de type
sauvage], et l’autre ayant un caractère familial [TTR mutée]),
nous comparerons ici l’épidémiologie, la pathogenèse, le
diagnostic et le traitement de l’ASS et de la cardiomyopathie
amyloïde familiale.
Amyloid Treatment and Research Program (F.L.R., J.L.B.) et département de médecine cardiovasculaire (F.L.R.), faculté de Médecine de l’université
de Boston et Centre médical de Boston, Boston Massachusetts, Etats-Unis.
Le supplément de données, uniquement disponible en ligne, peut être consulté, tout comme cet article, sur le site : http://circ.ahajournals.org/lookup/suppl/
doi:10.1161/CIRCULATIONAHA.111.078915/-/DC1.
Correspondance : Frederick L. Ruberg, MD, Section of Cardiovascular Medicine, Department of Medicine, Boston Medical Center, 88 E Newton St,
Boston, MA 02118, Etats-Unis. E-mail : frruber[email protected]
(Traduit de l’anglais : Transthyretin (TTR) Cardiac Amyloidosis. Circulation. 2012;126:1286–1300.)
© 2012 American Heart Association, Inc.
Circulation est disponible sur le site http://circ.ahajournals.org
183

12:48:15:04:13
Page 184
Page 184
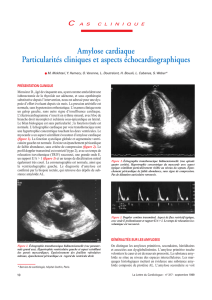
Figure 1. Coloration au rouge Congo du tissu myocardique d’un patient atteint d’une cardiomyopathie amyloïde. A, aspect en microscopie
optique ; B, aspect en microscopie en lumière polarisée, grossissement × 400.
Figure 2. Cardiomyopathie amyloïde à
transthyrétine étudiée par coloration
immunohistochimique. Des échantillons
biopsiques endomyocardiques ont été
colorés au moyen d’anticorps
respectivement dirigés contre (A) la chaîne
légère kappa, (B) la chaîne légère lambda,
(C) l’amyloïde sérique A et (D) l’amyloïde
de la transthyrétine. Aspects microscopiques
en lumière vive à grossissement × 400.
Epidémiologie
Amylose liée à l’âge ou ASS
L’amylose cardiaque liée à l’âge fut décrite pour la première
fois par Soyka en 1876,17 cela ayant été suivi de la publication
d’un grand nombre d’observations cliniques et de petites
séries de cas au cours des cent années ultérieures. En 1965,
Pomerance a estimé que la prévalence de l’amylose cardiaque
sénile était d’environ 10 % parmi la population âgée de plus de
80 ans et de 50 % chez les individus de plus de 90 ans.18 Les
autopsies pratiquées chez 85 patients consécutifs âgés de 80
ans ou plus ont mis en évidence des dépôts amyloïdes prenant
la coloration immunohistochimique de la préalbumine (TTR)
au niveau des oreillettes ou du ventricule gauche de 21 de ces
sujets, ce qui situe à 25 % la prévalence de l’amylose à TTR
liée à l’âge dans cette population âgée.19 Un examen plus
approfondi a toutefois révélé que seulement les deux tiers des
cœurs qui avaient pris la coloration de la TTR étaient le siège
d’infiltrats ventriculaires gauches, décrits comme «minimes et
très disséminés» dans plus de 50 % des cas. Ces observations
tendent à indiquer que l’amylose cardiaque à TTR n’a de
traduction histologique notable que chez 8 à 16 % des indi-
vidus de plus de 80 ans. Une étude prospective menée chez des
octogénaires finlandais (Vantaa 85+) a également objectivé la
présence de dépôts d’amyloïde de type TTR dans 25 % des
cœurs sur un total de 256 autopsies.20 Là encore, des infiltrats
cardiaques modérés à sévères n’ont été relevés que chez
seulement 5,5 % des sujets autopsiés.
La prévalence de l’ASS augmente incontestablement avec
l’avancée en âge, la quasi-totalité des patients étant âgés de
184 Circulation Mai 2013

12:48:15:04:13
Page 185
Page 185
plus de 60 ans lorsque le diagnostic de l’affection est porté.
Cette dernière présente une très forte spécificité sexuelle,
frappant environ 25 à 50 hommes pour une femme.21 Bien que
les investigateurs de l’étude finlandaise post-mortem n’aient
pas signalé de prédominance masculine des dépôts amyloïdes,
les colorations générées par ces derniers ont été plus marquées
(témoignant donc d’ASS plus sévères) chez les hommes que
chez les femmes. Par des mécanismes de vieillissement encore
mal cernés, l’agrégation et l’accumulation cardiaque de TTR
génétiquement normale augmente avec le temps. Les données
post-mortem tendent à montrer que les dépôts de TTR
de type sauvage, bien que mis en évidence par l’examen
histologique dans 25 à 30 % des tissus myocardiques de
septuagénaires et d’octogénaires, induisent une dysfonction
cardiaque chez un pourcentage plus faible mais néanmoins
significatif de sujets âgés. Compte tenu de l’augmentation
attendue du nombre d’octogénaires au cours des vingt
prochaines années, l’ASS semble appelée à devenir la forme
d’amylose cardiaque la plus courante.
Cardiomyopathie amyloïde familiale
Le gène de la TTR siège sur le chromosome 18q12.1 et s’étend
sur 4 exons et 5 introns. Il existe plus d’une centaine de
polymorphismes mononucléotidiques codant pour des
variants de cette protéine, 80 mutations pathogènes ayant
d’ores et déjà été identifiées.22 Ces mutations tendent à
s’agréger par zones géographiques ou groupements ethniques
et sont transmises sur le mode autosomique dominant. Le
phénotype clinique des amyloses à TTR mutées varie
fortement selon la mutation en cause, ce qui se traduit par
d’importantes différences touchant à l’âge de début du
trouble, à sa pénétrance, à son évolution clinique et à son
pronostic. La plupart des patients atteints d’une neuropathie
amyloïde familiale présentent une atteinte du système nerveux
accompagnée ou non d’amylose cardiaque.23 Le Tableau 1
décrit les variants le plus fréquemment responsables
d’amylose cardiaque à TTR mutée. La mutation qui est à la
fois la plus couramment cause de neuropathie amyloïde et la
mieux décrite est V30M (substitution de la valine par une
méthionine en position 30), qui touche principalement les
individus d’origine japonaise, portugaise ou suédoise. Dans
les populations présentant le génotype Met30, la pénétrance
de la maladie est variable, l’expression de cette dernière
dépendant du lieu de naissance, du sexe, de la transmission
génétique parentale et de l’âge.24 La mutation T60A (substitu-
tion de la thréonine par une alanine en position 60) affectant
la TTR est également une cause fréquente de neuropathies
et cardiomyopathies amyloïdes, présente chez 1 % de la
population d’Irlande du Nord-ouest (Comté de Donegal).25
Alors que, selon le Centre national britannique d’étude des
amyloses, près de 100 % des patients atteints d’une cardio-
myopathie amyloïde familiale à TTR T60A s’accompagnant
de neuropathie présenteraient une atteinte cardiaque,26
l’expérience américaine est plus hétérogène.
Parmi les variants de la TTR ayant principalement un
retentissement cardiaque, la substitution d’une valine par une
isoleucine en position 122 (V122I ou Ile122) est celle qui est la
plus répandue à travers le monde.27 Originellement décrite en
1989 par Gorevic et al,28 la prévalence de cette mutation
V122I a été estimée par Jacobson et al29,30 à près de 3 ou
4 % chez les Noirs américains, alors que ce variant n’est
pratiquement jamais mis en évidence dans la population
blanche.31 La mutation fondatrice V122I paraît avoir pris
naissance en Afrique de l’Ouest, ce qui expliquerait son
expression clinique dans les îles des Caraïbes (Haïti, Jamaïque
et Bermudes ; D. Jacobson, communication personnelle). Bien
que la pénétrance de cet allèle particulier soit inconnue,
il semble exister une étroite corrélation entre le statut de
porteur, la survenue d’une insuffisance cardiaque (risque
relatif de 2,6)32 et les caractéristiques échocardiographiques
de l’amylose cardiaque.33 A l’examen des échantillons qui
avaient été conservés pour les besoins de l’essai BEST (Beta-
Blocker Evaluation in Survival Trial [étude de l’influence du
traitement bêtabloquant sur la survie]), Buxbaum et al34 ont
constaté qu’environ 10 % des participants noirs insuffisants
cardiaques âgés de plus de 60 ans étaient porteurs de cette
mutation V122I, ce qui porte à penser que certains cas
d’insuffisance cardiaque pourraient être imputables à une
amylose cardiaque méconnue. Cet essai a porté sur des
patients présentant une dysfonction systolique (fraction
d’éjection ventriculaire gauche inférieure à 35 %), anomalie
cardiaque plus fréquemment observée quand la TTR est
l’objet d’une mutation de type V122I que lorsque d’autres
variants sont en cause.35,36 Selon de récentes données de
l’Office de statistiques des Etats-Unis, près de 1,5 million de
Noirs seraient porteurs de la mutation V122I et, donc,
exposés à développer une amylose cardiaque à TTR.37 Plus
précisément, les Noirs de plus de 65 ans qui sont atteints du
Tableau 1. Caractéristiques des amyloses cardiaques à transthyrétine de type sauvage et
de formes mutées communes
Ruberg et Berk L’amylose cardiaque à transthyrétine 185

12:48:15:04:13
Page 186
Page 186
variant V122I constituent une population encourant un
risque immédiat de survenue clinique d’une cardiomyopathie
à TTR ; sachant que, lors du recensement effectué en
2010, leur nombre a été estimé de l’ordre de 99 600 à
132 800 individus (soit entre 3 et 4 % des 3 320 000 Noirs), la
mutation V122I pourrait représenter une importante cause
d’insuffisance cardiaque dans la communauté noire âgée.
Pathogenèse
La transthyrétine, protéine formée de 127 acides aminés, est
codée par un unique gène dont les quatre exons ne représen-
tent que 7 kb d’ADN et qui siège sur le chromosome 18.38 A
l’état natif, la transthyrétine circulante est un tétramère
comportant deux sites C2 de liaison de la thyroxine
symétriques, ayant une forme d’entonnoir, au niveau de son
interface dimère-dimère.39 D’élégantes études thermo-
dynamiques ont montré que la dissociation du tétramère en
monomères de transthyrétine constitue l’étape auto-limitante
de l’anomalie de plissement de ces derniers, qui conduit à
la formation des fibrilles amyloïdes.16 Dans l’ASS, celles-ci
semblent se constituer sous l’influence de processus liés au
vieillissement qui ne sont encore qu’imparfaitement connus,
dont la modification biochimique post-traductionnelle
de la TTR de type sauvage ou de ses protéines chaperonnes.
Des observations recueillies chez la souris transgénique
surexprimant l’ASS humaine suggèrent que la propension
d’un cœur sénile à devenir amylosique serait subordonnée à
l’existence d’altérations de la synthèse hépatique de molécules
chaperonnes ou de l’épuration protéasomique de la protéine
non plissée.40 Dans la PAF, la substitution d’un acide aminé
au sein de la TTR native (TTR mutée) déstabilise le tétramère,
concourant ainsi à la fragmentation de la protéine en
monomères. Au final, le caractère amyloïdogène d’un variant
donné de la transthyrétine est déterminé par la capacité d’une
substitution d’acide aminé particulière à déstabiliser les
tétramères de TTR circulants, ce qui entraîne la libération des
monomères, condition indispensable pour que se produise
le plissement incorrect. A ce jour, plus d’une centaine de
variants de la TTR ont été décrits. Nombre de substitutions
d’acides aminés sous-tendent des profils d’atteintes organiques
spécifiques et donnent donc lieu à des évolutions cliniques
différentes. En règle générale, le variant de transthyrétine
découle de la substitution d’un seul nucléotide ; il apparaît
toutefois que le remplacement d’un acide aminé au sein de la
protéine peut résulter de la substitution de deux nucléotides
ou de la délétion complète d’un codon.41
Les organes atteints hébergent constamment des dépôts
amyloïdes extracellulaires. Les opinions divergent quant au
fait de savoir si ces dépôts sont effectivement responsables des
dysfonctions organiques ou s’ils ne constituent qu’un épi-
phénomène (témoin de la maladie). L’examen des biopsies de
nerf saphène externe pratiquées chez 31 patients porteurs
d’une mutation V30M de la TTR a objectivé la présence de
dépôts amyloïdes épineuraux et de dégénérescences nerveuses
chez la moitié de la cohorte. Aucun lien n’a pu être établi entre
l’existence de tels dépôts amyloïdes et les lésions histologiques
des nerfs,42 ce qui semble indiquer que ces dernières
relèveraient d’un autre mécanisme. Au niveau rénal, le degré
d’altération fonctionnelle n’est pas régi par l’importance des
dépôts amyloïdes.43,44 De plus, la réalisation de biopsies
rénales échelonnées chez des patients atteints d’amylose AL,
avant et après un traitement cliniquement efficace, a montré
que la charge en dépôts amyloïdes n’avait pas varié malgré la
nette amélioration de la protéinurie.45,46
Un nombre croissant de données atteste du rôle majeur
que jouent les protéines circulantes ou préfibrillaires dans
l’altération de la fonction cardiaque associée à l’amylose de
type AL ou à TTR. La perfusion de cœurs de souris par une
chaîne légère d’immunoglobuline clonale (AL-LC) issue de
patients présentant une cardiomyopathie amyloïde de type
AL induit rapidement une dysfonction diastolique. En
revanche, la fonction cardiaque ex vivo demeure inaltérée
lorsque la chaîne légère perfusée provient de patients
indemnes d’amylose AL.47 In vitro, l’exposition de cultures de
cardiomyocytes à des taux physiologiques d’AL-LC stimule la
production d’espèces réactives de l’oxygène ainsi que l’activité
de l’hème oxygénase de type 1, une protéine redox-sensible
qui est un marqueur des dommages cellulaires.48 En plus de
modifier le statut d’oxydoréduction intracellulaire des
cardiomyocytes, l’AL-LC diminue leur teneur en calcium et
leur contractilité, cela en l’absence de toute formation de
fibrilles amyloïdes.48 De récentes données montrent que
l’AL-LC modifie les mouvements ioniques au sein des
cardiomyocytes, ainsi que la contractilité et la mort
programmée de ces cellules par une voie de signalisation
non canonique des protéines kinases activée par le mitogène
p38α.49
Le même type de lésions des organes cibles occasionnées
par l’amyloïde à TTR préfibrillaire a été observé dans la PAF.
L’analyse immunohistochimique par anticorps anti-TTR et
l’examen en microscopie électronique à l’or colloïdal de
biopsies nerveuses pratiquées chez des individus qui étaient
porteurs asymptomatiques d’une mutation V30M de l’ATTR
ont mis en évidence des agrégats de protéines préfibrillaires
ne prenant pas la coloration au rouge Congo.50 L’état
d’activation du facteur nucléaire κB et des cytokines
pro-inflammatoires au sein de ces échantillons biopsiques
était la marque des effets toxiques exercés sur les cellules
par ces agrégats de TTR non fibrillaire, bien avant que
n’apparaissent les premiers signes cliniques de la maladie.
L’exposition de cultures neuronales à des agrégats de TTR
L55P non fibrillaire a induit la production de caspase 3 et
l’expression d’une mort cellulaire programmée. En revanche,
les fibrilles amyloïdes matures de TTR L55P n’ont nullement
stimulé l’expression de la caspase 3, ce qui tend à indiquer que
les agrégats de TTR préfibrillaire seraient les médiateurs
neurotoxiques de la maladie. D’autres observations portent à
penser que les récepteurs aux produits finals de glycation
avancée (RAGE) joueraient un rôle facilitateur dans les
lésions organiques induites par l’ATTR.51 Dans les études
originellement menées pour comparer les effets des amyloses
respectivement liées aux variants V30M et L55P de la TTR
chez la souris transgénique atteinte d’une PAF, aucune
différence n’a été objectivée quant à la toxicité nerveuse des
formes non fibrillaires de ces deux variants de la protéine.
Considérées dans leur globalité, les données recueillies à
partir des modèles d’amyloses AL et à TTR démontrent que
ce sont les agrégats de protéines préfibrillaires, et non les
186 Circulation Mai 2013

12:48:15:04:13
Page 187
Page 187
fibrilles amyloïdes matures, qui exercent des effets toxiques sur
les organes.
Diagnostic
Le diagnostic de l’amylose systémique repose sur l’identifica-
tion histologique des dépôts amyloïdes par la coloration
au rouge Congo. Contrairement à ce qui est de règle dans
l’amylose à chaîne légère (AL), il n’y a pas ici d’atteinte
cliniquement significative des reins et de la langue, de sorte
qu’il n’est généralement pas pratiqué de biopsies de ces
organes.36 L’aspiration de la graisse abdominale est une
approche biopsique de mise en œuvre aisée, réalisable au
cabinet médical, qui permet la mise en évidence des dépôts
amyloïdes chez près de 70 % des patients atteints d’une forme
liée à une mutation de la TTR telle que V122I.35 La biopsie
cardiaque demeure le meilleur moyen de diagnostiquer une
cardiomyopathie amyloïde, qui n’est pas grevé d’artefacts liés
au prélèvement (responsables de résultats faussement positifs
ou négatifs) comme cela peut se produire pour d’autres
affections infiltrantes telles que la sarcoïdose. Une fois la
présence de dépôts amyloïdes confirmée par la coloration
au rouge Congo, des colorations immunohistochimiques
spécifiques des chaînes légères κ et γ, de l’amyloïde A et de la
TTR peuvent être entreprises pour identifier la pré-protéine
en cause. Il peut être fait appel aux anatomopathologistes
d’un centre international de prise en charge des amyloses
pour avoir confirmation des résultats histologiques et de
la nature de la protéine amyloïdogène. Lorsque l’examen
immunohistochimique des dépôts amyloïdes a établi que la
protéine impliquée est la TTR, une analyse complémentaire
est nécessaire pour déterminer s’il s’agit de la protéine de
type sauvage ou d’une forme mutée. L’électrophorèse avec
focalisation isoélectrique permet, dans la plupart des cas,
d’effectuer ce diagnostic différentiel en se fondant sur la
charge de la protéine (Figure 3). Dans notre expérience,
la focalisation isoélectrique permet d’identifier près de 95 %
des variants examinés sur la base des différences de migration
Figure 3. Electrophorèse sur gel avec focalisation isoélectrique.
Sérums de patients atteints d’amyloses à transthyrétine (ATTR)
respectivement liées à une mutation V122I, à une transthyrétine
de type sauvage (TS) et à une mutation L58H. La flèche désigne
la migration de la transthyrétine de type sauvage. A noter,
la présence de deux bandes distinctes dans les colonnes se
rapportant aux protéines mutées V122I et L58H.
électrophorétique. La réalisation d’une réaction de poly-
mérisation en chaîne et d’un séquençage des exons 1 à 4 de la
TTR permet de valider les résultats de la focalisation iso-
électrique et d’affirmer le caractère normal ou muté du
génotype de la TTR. Une autre possibilité consiste à analyser
un prélèvement biopsique par la mise en œuvre conjointe
d’une spectrométrie de masse en tandem, d’une dissection
laser et d’une chromatographie liquidienne, ce qui permet
d’identifier la pré-protéine avec une sensibilité de 98 %.6 Il est
quelquefois possible de diagnostiquer l’amylose cardiaque à
TTR sans avoir à pratiquer de biopsie cardiaque ; dès lors que
la nature du variant de la TTR est établie, les biopsies
tissulaires réalisées au niveau d’autres sites confirment la
présence des dépôts amyloïdes à TTR, l’atteinte cardiaque
étant ensuite validée par des méthodes non invasives
(cf. infra).
Dans de nombreux centres internationaux de prise en
charge des amyloses, l’amylose AL et la gammapathie
monoclonale bénigne (ou de signification indéterminée) sont
les deux pathologies cliniques dominantes, ce qui rend parfois
difficile l’identification des amyloses à TTR de type sauvage
ou mutée. Lachmann et al52 ont ainsi découvert des mutations
de la TTR chez 4 % des patients adressés à un centre national
de prise en charge des amyloses en vue de l’exploration et du
traitement d’une supposée amylose AL. Aucun de ces patients
atteints d’amylose à TTR ne présentait d’antécédents
familiaux en faveur du caractère génétique de leur maladie.
Elément méritant d’être relevé, tous les patients atteints
d’une ATTR présentaient une cardiomyopathie. La coloration
immunohistochimique des coupes tissulaires a finalement
permis d’établir que la sous-unité protéique en cause était bien
la TTR.52 De même, Connors et al35 ont fait état d’amyloses
AL prouvées par biopsie chez 12 % des patients porteurs
d’une mutation V122I. Ces données issues de grands centres
de prise en charge des amyloses montrent combien il est
important d’identifier correctement la sous-unité protéique
formant les dépôts amyloïdes tissulaires, en particulier chez
les patients dont l’enquête génétique a révélé une positivité
pour l’ATTR.
Explorations non invasives
Le diagnostic de l’amylose cardiaque peut être porté en
s’appuyant sur une biopsie cardiaque invasive ou sur une
approche non intrusive qui, en fonction du contexte clinique,
reposera sur une exploration de confirmation non sanglante
et sur l’identification de dépôts amyloïdes dans des tissus
extra-cardiaques tels que la graisse abdominale prélevée par
aspiration (Figure 4). Les méthodes actuelles de diagnostic
non invasif de l’amylose cardiaque à TTR comprennent
l’échocardiographie avec imagerie de déformation, l’imagerie
par résonance magnétique cardiaque (IRMC), l’électro-
cardiographie (ECG) et la recherche des biomarqueurs
sériques tels que le peptide natriurétique de type B (BNP
ou fragment N-terminal du pro-BNP) ou les troponines car-
diaques (T et I). L’examen physique ne permet habituellement
pas d’identifier le type d’amyloïde en cause, à l’exception
notable de la macroglossie et des ecchymoses périorbitaires
qui sont pathognomoniques de l’amylose AL.36 Les signes
physiques varient fortement selon la sévérité de la dysfonction
Ruberg et Berk L’amylose cardiaque à transthyrétine 187
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
1
/
18
100%