1. L`acide palmitique 1.1. Un acide gras est un acide carboxylique

1. L’acide palmitique
1.1. Un acide gras est un acide carboxylique ayant une longue chaîne de carbone linéaire, non ramifiée, possédant ou
non des doubles liaisons.
1.2. Un acide gras saturé ne compte aucune double liaison entre les atomes de carbone. Il vérifie la formule
CnH2n+1 - COOH
Pour n = 15, on obtient alors une formule brute C15H31 - COOH, formule brute de l’acide palmitique ... c’est donc bien
un acide gras saturé.
Remarques. Il faut bien rédiger le raisonnement ... c’est trop brouillon en général ... bien détailler la réflexion pour trouver
la réponse.
2. La palmitine.
2.1. Le glycérol contient les 3 groupes caractéristiques de l’alcool.
2.2. La formule brute du glycérol est C3H8O3
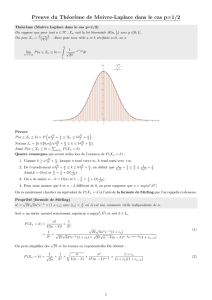
2.3. Le montage à reflux
Sortie d’eau
Arrivée d’eau
Réfrigérant
Ballon
Plateau élévateur
Chauffe ballon
2.4.1. La palmitine contient les 3 groupes caractéristiques des esters.
2.4.2. Un triglycéride est un triester, car il contient 3 fonctions ester.
2.5.
3

1.1. L’acide lactique contient les fonctions caractéristiques de la famille des alcools et des acide carboxyliques.
1.2. La formule brute est C3H6O3. On en déduit la masse molaire moléculaire
M = 3 x M(C) + 6 x M(H) + 3 x M(O) = 3 x 12 + 6 x 1 + 3 x 16 = 90 g/mol.
2.1. Pour déterminer le volume versé à l’équivalence, on applique la méthode des tangentes:
VEq = 12 mL
2.2. L’équivalence acido-basique, est l’instant où les réactifs sont introduits dans les proportions stoechiométriques. A la
vue de l’équation du dosage, on peut écrire: nAcide Lactique = nSoude
Comme n = C x V, on en déduit CA x VA = CB x VBE
CB x VBE 5,0 x 10-2 x 12,0
2.3. On peut alors en déduire la relation CA = = = 0,030 mol/L
VA20,0
2.4. Cette concentration, signifie que dans 1 L de lait, il y a 0,030 mol d’acide lactique.
On en déduit alors la masse correspondante m = n x M = 0,030 x 90 = 2,7 g.
2.5. D’après l’énoncé, un lait est frais lorsque la masse d’acide lactique est inférieure à 1,8 g par litre de lait. Ayant
trouvé ici une masse de 2,7 g dans 1 Litre de ce lait, on en déduit que le lait n’est pas frais.

Partie 1. La vitesse
50 km 50 000 m
1.1. On rappelle que 1 m/s = 3,6 km/h, on en déduit une vitesse v1 = 50 km.h-1= = =14 m/s
1 h 3 600 s
1 1
1.2. On en déduit l’énergie cinétique : Ec1 = m x v1² = 1 800 x 14² = 176 400 J
2 2
Remarque. Ne pas oublier d’élever la vitesse au carré et de prendre la vitesse en m/s et pas en km/h.
1.3. La vitesse v2 = 100 km.h-1= 28 m/s.
1 1
On en déduit l’énergie cinétique : Ec1 = m x v1² = 1 800 x 28² = 705 600 J
2 2
Ec2705 600
1.4. Le rapport = = 4
Ec1176 400
1.5. On en déduit que si la vitesse d’une voiture est mulitpliée par deux alors son énergie cinétique Ec est multipliée par
4.
Partie 2. Les conditions extérieures.
2.1. La distance d’arrêt est la distance parcourue par le véhicule pour s’arrêter: DA = DR + DF.
Remarques. La distance d’arrêt, ce n’est pas:
«la distance qui doit séparer deux véhicules sur une route» ...... réponse incomplète
«la distance pour freiner» ... il manque la distance de réaction.
2.2. L’alcoolémie du conducteur, la prise de cannabis ont une influence sur la distance de réaction.
L’état des pneus du véhicule et la présence de verglas sur la route ont une influence sur la distance de freinage.‘
2.3. A 90 km/h, la distance d’arrêt est de 80 m pour une alcoolémie nulle et de 100 m pour une alcoolémie à 0,5 g/L.
100 m
80 m
2.4. La distance d’arrêt est plus grande avec une alcoolémie de 0,5 g/L, car le temps de réaction étant lié à l’état du
conducteur, avoir bu de l’alcool, augmente le temps de réaction, donc la distance de réaction, donc la distance d’arrrêt.
1
/
3
100%