modele animal de sarcoïdose pulmonaire chez le rat par l`adjuvant

SOPHIE BOIVIN
MODELE ANIMAL DE SARCOÏDOSE PULMONAIRE
CHEZ LE RAT PAR L'ADJUVANT DE FREUND
COMPLET :ANALYSES DE PARAMÈTRES DE
L'INFLAMMATION ET DE L'EFFICACITÉ D'UN
AGONISTE NICOTINIQUE COMME THÉRAPEUTIQUE
Mémoire présenté
à la Faculté des études supérieures de l'Université Laval, Québec
dans le cadre du programme de maîtrise en médecine expérimentale
pour l'obtention du grade de maître es sciences (M.Sc.)
FACULTE DE MEDECINE
UNIVERSITÉ LAVAL
QUÉBEC
2007
© Sophie Boivin, 2007

II
Résumé
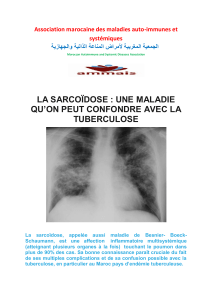
La sarcoïdose est une maladie inflammatoire multisystémique s'attaquant aux poumons
dont l'étiologie demeure inconnue. Elle est caractérisée par l'accumulation de granulomes non-
caséeux dans les organes touchés. L'appareil pulmonaire est fréquemment atteint par la
sarcoïdose et d'importants changements de population cellulaire sont observés dans le fluide
récolté lors de lavages bronchoalvéolaires (LBA). Une étude précédente a démontré la
possibilité d'utiliser un modèle animal de rat pour l'étude de cette maladie. Cette étude a
démontré que l'adjuvant complet de Freund (CFA) administré par voie intraveineuse (IV) à deux
reprises induit l'apparition de granulomes qui furent, par la suite, analysés par tomographie
axiale. Le projet de recherche décrit dans ce mémoire a visé à développer, à partir du modèle
déjà connu, un modèle mieux toléré par les animaux et à analyser les caractéristiques cellulaires,
histologiques et immunologiques de celui-ci. De plus, certains agonistes des récepteurs
nicotiniques, molécules ayant des propriétés anti-inflammatoires, seront testés sur le modèle
comme traitement potentiel. Il fut démontré lors de cette étude qu'une seule injection de CFA
cause l'apparition de granulomes dans les poumons des animaux et que cette injection est bien
tolérée par les animaux. Les analyses cellulaires des LBA des animaux malades ont permis de
noter une forte similarité avec la sarcoïdose pulmonaire humaine. De plus, le profil
immunologique des animaux était très près de la pathologie humaine. Finalement, l'utilisation
des agonistes nicotiniques n'a pas permis d'atténuer l'inflammation reliée à cette pathologie
granulomateuse.

m
Avant-propos
Ce mémoire de maîtrise résume le travail de recherche et de laboratoire accompli durant l'année et demie
que dura ma maîtrise. Il est divisé en cinq chapitres permettant de comprendre la pathologie à laquelle je m'attarde,
de mesurer la nécessité d'un modèle animal, d'une thérapie efficace et finalement de démontrer les progrès effectués
dans ces différentes voies. Un article scientifique portant sur ces recherches sera rédigé sous peu et présenté pour
publication.
Je suis très heureuse d'avoir pris la décision de faire une maîtrise en médecine expérimentale. Ce fut une expérience
extrêmement enrichissante qui m'a permis de mesurer mes capacités et mes limites. Mais surtout cette maîtrise m'a
dirigé vers la carrière future auquel je me dédie. Grâce au Dr. Cormier qui m'a rapidement poussé à présenter mes
résultats lors de différents congrès, j'ai pu constater que la communication était mon avenir. Merci au Dr. Cormier
qui m'a fait confiance dès le début et qui m'a permis de mesurer à quel point j'aime transmettre des connaissances
scientifiques. Je le remercie aussi pour son écoute lorsque j'avais des questionnements et pour ses nombreux
conseils prodigués avec beaucoup de compréhension. Une mention spéciale pour les cours de jardinage.
Je ne pourrais passer sous silence l'aide indéfectible d'Evelyne Israël-Assayag qui était toujours présente pour me
conseiller et me diriger dans mes travaux. J'ai apprécié particulièrement ta porte qui m'étais toujours ouverte et
l'attention que tu porte à tes étudiants. Je voudrais aussi dire un gros merci à Marie-Josée Beaulieu pour ses mimes
qui m'ont immédiatement mise en confiance, mais surtout pour son aide lorsque mes journées me semblaient
irréalisables! Une mention spéciale à Mélissa Girard qui a été pour moi une figure très importante lors de ma
maîtrise. Tu as toujours répondu à mes mille et une questions, tu m'as soutenue, appuyée, bref tu as toujours été
présente pour moi. Mille merci! Un gros remerciement à tout le reste de l'équipe Cormier passée et présente; Marie-
Renée, Geneviève, Arnold, Yakob, Annick et Magalie. Et comment passer sous silence l'aide que m'ont apporté
Justin, Guy et Sébastien les techniciens en santé animale du Centre de recherche. Merci au Centre de Recherche de
l'Hôpital Laval pour le soutien financier qu'il m'a accordé.
Finalement, un gros gros remerciement à mes parents Marie et Gaétan qui m'ont appuyée dans mes démarches et à
ma sœur Catherine qui était toujours présente pour moi.
Merci à tous ceux qui ont contribué à mon succès!

IV
Table des matières
Pages
Résumé II
Avant-propos III
Table des matières IV
Liste des tableaux VI
Liste des figures VII
Liste des abréviations VIII
Chapitre
1
; Introduction
1.1 Pathologie; la sarcoïdose 2
1.2 La prévalence 3
UÉtiologie 3
1.3.1 Facteurs génétiques 3
1.3.2 Agents infectieux 4
1.3.3 Agents organiques et inorganiques 5
1.4 Symptômes 5
1.5 Diagnostique 6
1.6 Traitements 7
1.7 Granulome, contenu et formation 9
1.8 Caractéristiques cellulaires 10
1.8.1 Le lymphocyte T 11
1.8.2 Le macrophage alvéolaire 12
1.8.3 Le neutrophile 12
1.9 Les cytokines et chimiokines 13
1.9.1 L'interleukine-1 13
1.9.2 L'interleukine-2 13
1:9.3 L'interleukine-4 14
1.9.4 L'interleukine-6 14
1.9.5 L'interleukine-10 14
1.9.6 L'interleukine-12 15

V
1.9.7 L'interleukine-13 15
1.9.8 L'interleukine-15 16
1.9.9 L'interleukine-18 16
1.9.10
L'interféron-gamma 16
1.9.11
TNF 17
1.10 Distinction entre sarcoïdose, alvéolite allergique et tuberculose 17
1.10.1
Alvéolite allergique 17
1.10.2
Tuberculose 18
1.11 Modèles animaux de granulomes pulmonaires 18
1.11.1
Le béryllium 19
1.11.2
L'adjuvant complet de Freund 19
1.12 Nicotine 20
1.12.1
Récepteurs nicotiniques 20
1.12.2
Agonistes des récepteurs nicotiniques 21
Chapitre 2; Objectif général et objectifs spécifiques 23
Chapitre 3; Méthodologie 25
Chapitre 4; Résultats .30
Chapitre 5; Discussion et conclusion 42
Bibliographie 48
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
1
/
60
100%