Entrainement_devoir_..

!Entrainement!au!devoir!surveillé!de!chimie!n°6!
!
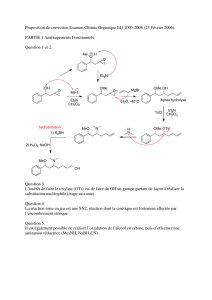
Problème!de!chimie!organique!(correction!sur!fichier!pdf!séparé)!
!
De# nombreux# alcaloïdes# faisant# partie# de# la# classe# des# éphédradines# présentent# comme# point#
commun# le# motif# «#aryldihydrofurane#»,# à# savoir# deux# cycles# aromatiques# et# un# dihydrofurane# (1@
oxacylopent@2@ène)#:#!
R2
R1
O
H
H
N
O
H
NH
O
NH
HN
R1 = H ; R2 = OH : éphédradine A
R1 = OCH3 ; R2 OH : éphédradine B
R1 = R2 = OCH3 : éphédradine C
#
Dans#ce#problème,#nous#nous#intéressons#à#la#synthèse#de#ce#motif#à#partir#de#la#vanilline.##
#
De#nombreuses#questions#sont#indépendantes.#Ne#vous#laissez#pas#impressionner#par#la#taille#des#
molécules.# Il# est# possible# de# simplifier# celles:ci# lors# de# l’écriture# des# mécanismes# s’ils# sont#
demandés.#Le#sujet#comporte#de#nombreux#documents#auxquels#ils#convient#de#se#référer.#
#
@iPr#=#isopropyle#(@CH(CH3)2)# @Me#=#méthyle#(@CH3)# @Et#=#éthyle#(@CH2CH3)#
#
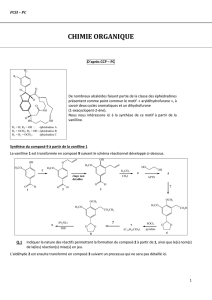
I. Obtention!du!composé!9!à!partie!de!la!vanilline!1!
!
La# vanilline# 1#est# transformée# en# composé# 9#de# formule# brute# !"#$"%&'()* suivant# le# schéma#
réactionnel#développé#dans#le#document!1.##
#
1) Etude!de!la!transformation!1!!2!
!
a) Donner#un# ordre#de#grandeur#du# pKa#du# couple# acido@basique#
PhOH/PhO−
#et#du#couple#
EtOH/EtO−
.#Justifier#cette#différence.#
b) Proposer#deux#méthodes#de#formation#de#l’ion#éthanolate#à#partir#de#l’éthanol#et#de#tout#
autre# réactif# minéral.# Dans# chaque# cas,# écrire# l’équation# de# la# réaction# mise# en# jeu# et#
donner#le#type#de#réaction.##
c) Indiquer#la#nature#des#réactifs#permettant#la#formation#du#composé#2#à#partir#de#1,#ainsi#
que#le#mécanisme#de#la#réaction.#Justifier#le#mécanisme#choisi.#
d) Interpréter#les#spectres#IR#et#RMN#1H#de#la#vanilline#(documents!2!et!3)##
#
2) On# traite# 3#par# l’iodométhane# en# présence# de# carbonate# de# potassium.# Représenter# la#
structure#topologique#du#produit#4.#Quel#est#le#nom#de#la#réaction#mise#en#jeu#?!
3) Le#composé#4! est#traité#par#un#excès#d’éthane@1,2@diol#dans#l’acide#+,-,.toluènesulfonique#
pour#conduire#au#composé#5.!Donner#la#formule#topologique#du#composé#5.#(Document!4)!
4) 5#est#traité#par#de#l’ozone#O3#en#présence#d’eau#oxygénée.#Il#se#forme#le#composé#6.#Quelle#
est#la#nature#de#la#transformation#5!!!6#?#!

#
La#transformation#6#!7#n’est#pas#étudiée.#
!
5) Les# atomes# d’hydrogène# portés# par# le# carbone# en# alpha# de# la# fonction# ester# de# 8!
(volontairement# représentés)# possèdent# des# propriétés# acides.# Le# composé# 8#traité# par# le#
LDA#(diisopropylamidure#de#lithium#iPr2NLi)#conduit#au#sel#9,#/,01*234567681#de#8.#Donner#la#
structure#du#composé#9#et#justifier#l’obtention#favorable#du#carbanion#9.!
!
II. Détermination!de!la!structure!du!composé!10.!
!
Le#composé#10#a#pour#formule#brute#C8H8O2.#Le#spectre#IR#de#10#présente,#entre#autre,#les#bandes#
caractéristiques#suivantes#:##
#
3035#cm@1#;#2911#cm@1,#1702#cm@1#et#1601#cm@1.#
#
La#spectre#de#RMN1H#de#10#enregistré#à#250#MHz#dans#CDCl3#est#donné#dans#le#document!5.#
#
6) Déterminer#la#structure#de#10#en#détaillant#les#étapes#du#raisonnement.#
#
III. Obtention!du!motif!«!aryldihydrofurane!»!
Le#composé#aryldihydrofurane#15#est#obtenu#selon#la#suite#de#réactions#détaillée#dans#le#document!6.##
#
7) Le#carbanion#9#se#comporte#comme#un#réactif#de#Grignard9*9#réagit#avec*:,*;342<)34*,:=8>?=1#
de# 10#conduit,# après# hydrolyse,# à# :@,:233:* 01234=,)-1#11.# Donner# la# structure# de# 11#et#
proposer# un# mécanisme# simple# pour# expliquer# sa# formation.# On# pourra# utiliser# une#
représentation# simplifiée# du# carbanion# 9#mais# la# formule# topologique# de# 11#devra# être#
représentée.!
8) Justifier#l’intérêt#probable#de#la#transformation#4!!!5.!
9) (1* 2>:3-6-1* =1* A80?<):1*ou# 2>:3-6-1* =1* A8<>,406:;34?:1*B!$CD&E!:F*43<8* G0!:*,* +36-*
0<-62<6-1*:!
!
H3C S
O
O
Cl
#
# #
Le# composé# 11#est# traité# par# G0!:#en# présence# de# triéthylamine# Et3N# (même# rôle# que# la#
pyridine).# Donner# la# formule# topologique# de# 12#et# préciser# le# rôle# probable# de# cette#
transformation.#
#
10) Le#composé#12,#traité#par#une#solution#de#bromure#de#lithium#LiBr#dans#le#diméthylsulfoxide#
(ou# DMSO,# solvant#de# la# réaction)# conduit# à# 13.# Ecrire# le# mécanisme# de# sa# formation# et#
justifier#le#choix#du#mécanisme.#Expliquer#pourquoi#
CH3SO3
−
#est#un#/34*462:83;671*(on#pourra#
donner#sa#structure#de#Lewis).#!
!
Le#composé#13#est#transformé#en#composé#14#suivant#des#étapes#non#étudiées#ici.##
#
11) Le# dérivé# bromé# 14#traité# par# le# <1-<@butylate# de# potassium# comme# base# se# cyclise# en#
composé#15.#Ecrire#le#mécanisme#de#la#réaction,#sans#se#soucier#de#la#stéréochimie.!
12) La#molécule#15#possède@t@elle#une#activité#optique#?#Justifier#clairement.#!

13) Combien# de# centres# asymétriques# possède# le# composé# 15#?# Donner# le# descripteur#
stéréochimique#de#ces#centres#stéréogènes#en#justifiant#la#réponse.#!
14) Combien# 15#possède@t@il# d’énantiomère(s)# et# de# diastéréoisomère(s)#éventuels#?# Les#
représenter# en# indiquant# les# relations# de# stéréoisomérie#;# on# utilisera# une# représentation#
simplifiée.#!
#
IV. Synthèse!d’un!nouvel!aldéhyde!aromatique!dans!le!but!d’obtenir!des!analogues!
de!15.!
!
D’autres#structures#de#type#aryldihydrobenzofurane#peuvent#être#obtenues#en#modifiant#la#nature#de#
l’aldéhyde# aromatique# mis# en# jeu# lors# de# la# synthèse.# Pour# cela,# la# synthèse# décrite# dans# le#
document!7!a#été#menée.##
#
15) L’aldéhyde# 16#est# traité# par# le# tétrahydruroborate#de# sodium# NaBH4#dans# le# méthanol#et##
conduit#à#17.#Donner#le#mécanisme#de#la#transformation#16! !!17#et#préciser#la#nature#de#
cette#transformation.!
16) La# réaction# 17! !!18#est# la# transformation# d’un# alcool# en# dérivé# chloré# correspondant#
(ROH!RCl).#Proposer#des#conditions#opératoires#raisonnables#pour#cette#transformation.#Le#
mécanisme#n’est#pas#demandé.#!
17) Le# composé# 18#réagit# avec# le# cyanure# de# potassium.# Donner# la# formule# de# Lewis# de# l’ion#
cyanure#CN@#et#le#mécanisme#de#la#réaction.#Quel#est#l’intérêt#de#l’étape#17!!!18#?#!
#
On# réalise# un# suivi# par# chromatographie# sur# couche# mince# en# silice# de# la# réaction# 16! !!17.# Le#
chromatogramme#obtenu#est#le#suivant#:#!
!
ABC
A : aprés traitement de la réaction
B : prélèvement pendant la réaction
C : avant ajout de tetraborohydrure de sodium
!
#
Système# éluant#:# cyclohexane/acétate# d’éthyle# 10/90#;# la# plaque# de# silice# est# tapissée# de#
groupements#donneurs#et#accepteurs#de#liaisons#hydrogène.#
#
18) Interpréter#le#chromatogramme#obtenu#;#identifier#les#tâches#et#calcul#leur#rapport#frontal.!
#
#
#
#
#
#
#
#
#

#
#
Données#
#
•
pKa(HCO3
−/CO3
2−)=10,4
• Données!spectrales
#
#
Document!1!:!préparation!de!l’intermédiaire!9!à!partir!de!la!vanilline!1.!
!
OH
O H
MeO
?
O
O H
MeO
étape non
détaillée ici
OH
O H
MeO
K2CO3
CH3I
4
HO
OH
APTS
OMe
MeO
O O
?
OMe
MeO
O O
CO2H
SOCl2
pyridine
7
(C13H15ClO5)
OMe
MeO
O O
CO2CH3
iPr2NLi
THF
123
5
6
8
9
étape non
détaillée ici
H H
#
O3,#H2O2#
5!

!
!
!
Document!2!:!spectre!IR!de!la!vanilline.!
Document!3!:!spectre!de!RMN!1H!de!la!vanilline.!
!
!
 6
6
 7
7
1
/
7
100%