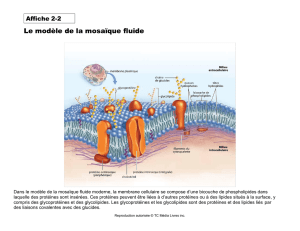
Techniques d`extraction et de caractérisation d`une protéine

Techniques d'extraction et de caractérisation d'une protéine
Doc 1:
Centrifugation différentielle
Doc 2:
Doc 3:

Doc 4:
Solubilité de la β-galactosidase en fonction du pH à différentes concentrations de sels (NaCl).
Doc 5:
Séparation de macromolécules par chromatographie d'affinité. Les carrés échancrés, les demi-cercles,
et les triangles représentent schématiquement les sites de liaison du ligand sur les macromolécules.
Seuls les sites de liaison du ligand représentés par des cercles oranges avec des échancrures
triangulaires se lient spécifiquement aux ligands ancrés à la matrice chromatographique. Toutes les
autres macromolécules ne sont pas retenues et sont éluées lors du lavage.

Doc 6: Chromatographie par gel-filtration
Représentation schématique de la chromatographie par exclusion de taille (gel-filtration).
(a) Une bille de gel est constituée d'un gel-matrice et de canaux internes qui renferment un volume
interne de solvant. Les petites molécules peuvent entrer librement dans les espaces internes remplis de
solvant. Par contre, les plus grosses molécules ne peuvent pas entrer dans les porcs des billes du gel.
(b) La solution échantillon commence à entrer dans la colonne de gel. Les plus petites molécules (en
rouge) peuvent pénétrer dans les pores du gel, et sont plus ralenties que les molécules plus grosses (en
bleu) qui ne peuvent pas entrer dans les pores du gel.
(d) Les plus grosses molécules sortent les premières de la colonne, tandis que les plus petites sortent
les dernières.
La chromatographie d'exclusion
moléculaire, également appelée gel-
filtration. Celte méthode sépare des
protéines selon leur taille. La colonne
contient un polymère avec des pores
de taille sélective. Les plus grandes
protéines migrent plus vite que les plus
petites parce qu'elles sont trop
grandes pour entrer dans les pores
des billes et prennent donc une route
plus directe à travers la colonne. Les
plus petites protéines entrent dans les
pores et sont ralenties par les voies
labyrinthiques qu'elles doivent prendre
à travers la colonne.

Doc 7: Détermination de la masse moléculaire d'une protéine par chromatographie par gel-filtration
Chromatographie par gel-filtration : méthode de séparation fondée sur la taille des molécules.
Déroulement d'une chromatographie par tamisage moléculaire.- Filtration sur gel
a : deux protéines, A et B (MA > MB), sont séparées,
b : relation linéaire entre le volume d'élution V, et le logarithme décimal de la masse moléculaire.
M (α : lactoglobuline, 37 kDa; β : ovalbumine, 48 kDa: γ :phosphatase alcaline, 80 kDa; δ : lactate
déshydrogénase. 135 kDa).

Doc 8: Détermination de la masse moléculaire d'une protéine par Electrophorèse SDS-Page
La combinaison du sodium
dodécylsulfate avec une protéine.
En rosé : tête négativement
chargée du SDS.
Électrophorèse sur gel de
polyacrylamide en présence de SDS des
protéines de la membrane érythrocytaire
humaine (d'après Alloisio N. et al.. Hum.
Genêt. : 59. 68-71, 1981).
a : nomenclature numérique des
protéines les plus abondantes, colorées
par le bleu de Coomassie : 1 : α-
spectrine. 2 : β-spectrine; 2.1 : ankyrine:
3 : transporteur des anions. 4.1 et 4.2 :
bandes innominées; 5 : actine
(monomère); 6 : glycéraldéhyde 3-
phosphate déshydrogénase.
b : représentation graphique de la
distance de migration en fonction du
logarithme de la masse moléculaire
(exprimée en Da).
 6
6
 7
7
 8
8
 9
9
1
/
9
100%