Wetenschappelijke bijsluiter

1. DENOMINATION DU MEDICAMENT
SIBELIUM comprimés 10 mg
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
11,8 mg de chlorhydrate de flunarizine équivalant à 10 mg de flunarizine
Pour la liste complète des excipients, voir rubrique 6.1
3. FORME PHARMACEUTIQUE
comprimés
4. DONNEES CLINIQUES
4.1 Indications thérapeutiques
1. Prophylaxie de la migraine chez les patients ayant des crises fréquentes et
graves, et ayant présenté des effets secondaires inacceptables lors d'autres
traitements et/ou n'ayant pas suffisamment réagi à ces derniers.
2. Traitement symptomatique du vertige vestibulaire consécutif à un trouble
fonctionnel diagnostiqué du système vestibulaire.
4.2 Posologie et mode d’administration
1. Prophylaxie de la migraine:
Dose initiale :
Le traitement débute par une dose de 10 mg par jour (le soir) chez les patients de
moins de 65 ans, et par une dose de 5 mg chez les patients de plus de 65 ans. Etant
donné la longue demi-vie d’élimination, une seule prise par jour est suffisante. Si des
symptômes dépressifs, des réactions extrapyramidales ou d'autres effets
secondaires inacceptables apparaissent en cours de traitement, celui-ci doit être
arrêté.
Si, 2 mois après le début du traitement, aucune amélioration significative n'est
observée, le traitement est à considérer comme non efficace et il doit également être
arrêté.
Traitement d’entretien :
Si le patient réagit favorablement au traitement, et si un traitement d'entretien est
souhaité, la dose journalière est réduite, ou la médication est prise tous les 2 jours,
ou pendant 5 jours chaque fois suivis de 2 jours consécutifs sans médication par
semaine. Après 6 mois, le traitement d'entretien est arrêté. Si le patient rechute, un
nouveau traitement peut être instauré.
2. Vertige:
On utilise la même dose que pour la migraine, avec cette nuance que le traitement
n'est pas administré plus longtemps que nécessaire pour maîtriser les symptômes,
c'est-à-dire généralement pas plus de 2 mois. Si après 1 mois de traitement d'un
vertige chronique et après 2 mois de traitement d'un vertige paroxystique, on ne
constate aucune amélioration significative, le traitement est à considérer comme non
efficace et doit être arrêté.
4.3 Contre-indications
La flunarizine est contre-indiquée chez les patients atteints de maladies dépressives,
chez les patients présentant des antécédents de troubles dépressifs, et chez ceux
dont l’anamnèse inclut des phénomènes parkinsoniens ou d'autres troubles

extrapyramidaux ; le médicament est également contre-indiqué chez les personnes
ayant une hypersensibilité connue à la flunarizine ou à l’un des excipients.
4.4 Mises en garde spéciales et précautions d’emploi
SIBELIUM ne convient pas pour neutraliser immédiatement une crise de vertige.
SIBELIUM doit être utilisé avec la prudence requise chez les patients souffrant de
porphyrie.
Dans de rares cas, une fatigue peut se manifester progressivement pendant un
traitement par SIBELIUM. Si tel est le cas, il faut arrêter le traitement.
La dose conseillée ne peut être dépassée. Les patients doivent être contrôlés à
intervalles réguliers, en particulier lors d'un traitement d'entretien, de sorte que les
éventuels symptômes extrapyramidaux ou dépressifs puissent être décelés à un
stade précoce et que le traitement puisse être arrêté, le cas échéant. Si l'efficacité
thérapeutique diminue pendant un traitement d'entretien, le traitement doit également
être arrêté.
Avertissement spécial:
Ce traitement peut donner lieu à des symptômes extrapyramidaux et dépressifs.
Chez les personnes prédisposées (comme les patients âgés), un parkinsonisme peut
apparaître. On utilisera donc SIBELIUM avec prudence chez ces patients.
4.5 Interactions avec d’autres médicaments et autres formes d’interactions
Une sédation accrue peut se manifester lorsqu'il y a prise simultanée d'alcool, de
somnifères ou de calmants.
SIBELIUM n'est pas contre-indiqué pendant un traitement par bêta-bloquants.
Les substances qui activent les enzymes hépatiques microsomiques, comme la
carbamazépine, la phénytoïne, les contraceptifs oraux et les barbituriques, peuvent
accélérer la métabolisation de la flunarizine, ce qui peut mener à une diminution de
l’efficacité. Dans certains cas, une adaptation de la dose est alors requise.
4.6 Grossesse et allaitement
Il n'existe aucune donnée sur l'innocuité de SIBELIUM pendant la grossesse chez
l'être humain. Les études chez les animaux ne révèlent pas d'effets nocifs directs ou
indirects sur la reproduction, le développement de l'embryon ou du fœtus, le
déroulement de la grossesse et les événements péri- et postnatals.
Cependant, étant donné que l’innocuité de SIBELIUM pendant la grossesse n’est pas
certifiée, l’utilisation de ce médicament pendant la grossesse n’est pas indiquée.
Des études chez des chiennes qui allaitent ont montré que SIBELIUM est excrété
dans le lait maternel et que sa concentration est plus élevée dans le lait que dans le
plasma. Aucune donnée n'est connue quant à l'excrétion de SIBELIUM dans le lait
maternel chez la femme.
Etant donné que l’innocuité de SIBELIUM pendant l’allaitement n’est pas certifiée,
l’utilisation de ce médicament pendant l’allaitement est déconseillée.
4.7 Effets sur l’aptitude à conduire des véhicules et à utiliser des machines
En ce qui concerne la conduite de véhicules ou l’utilisation de machines, la prudence
est de rigueur lorsqu’il se produit durant le traitement une somnolence initiale
éventuelle ou une somnolence ne disparaissant pas spontanément.
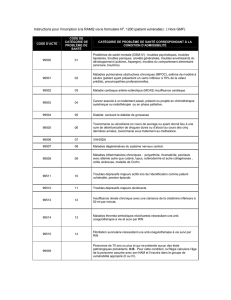
4.8 Effets indésirables
Pour chaque catégorie de systèmes organiques, on a classé les effets indésirables
en fonction de la fréquence et en appliquant la convention suivante : très souvent
(1-10%), parfois (0,1-1%), rarement (0,01-0,1%) et très rarement (<0,01%) – cette

classe incluant les rapports isolés.
Sur la base de l'expérience acquise après la commercialisation, les effets
indésirables suivants ont également été signalés :
• Troubles métaboliques et nutritionnels
souvent: gain de poids dans la prophylaxie de la migraine
• Troubles psychiques
très souvent: somnolence, fatigue
parfois: dépression (surtout chez les femmes dont l’anamnèse inclut des
symptômes dépressifs), insomnie, augmentation de l’appétit
rarement: anxiété
• Troubles liés au système nerveux
parfois: symptômes extrapyramidaux tels que bradykinésie, rigidité, acathisie,
dyskinésie orofaciale, tremblement (surtout chez les patients âgés)
• Troubles gastro-intestinaux
parfois: pyrosis, nausées, gastralgie, sécheresse buccale
• Affections cutanées et troubles du tissu sous-cutané
parfois: rash
• Affections des muscles squelettiques, du tissu conjonctif et des os
parfois: douleurs musculaires
• Perturbations du système reproducteur et troubles mammaires
rarement: galactorrhée
4.9 Surdosage
En cas de surdosage, de la somnolence ou de l'asthénie peuvent apparaître. Celles-
ci disparaissent lorsqu'on arrête le traitement.
Quelques cas de surdosage aigu (plus de 600 mg par prise) ont été rapportés. Les
symptômes observés étaient: sédation, agitation et tachycardie. Le traitement d'un
surdosage aigu consiste à administrer du charbon officinal, à induire le vomissement
ou à pratiquer un lavage d'estomac, et à appliquer des mesures de soutien. Il
n'existe pas d'antidote spécifique.
5. PROPRIETES PHARMACOLOGIQUES
5.1 Propriétés pharmacodynamiques
Catégorie pharmacothérapeutique : AUTRES MEDICAMENTS LIES AU SYSTEME
NERVEUX CENTRAL, ANTIVERTIGINEUX
Code ATC : N07C A03
La flunarizine est un bloqueur de l'entrée de calcium exerçant une activité sélective,
de sorte que la contractilité, la conduction et la stimulation cardiaques ne sont pas
influencées. Le médicament prévient une "inondation calcique" cellulaire en réduisant
les influx calciques excessifs à travers la membrane cellulaire.
La flunarizine est le prototype des antagonistes du calcium de la classe IV
(classification OMS).
5.2 Données pharmacocinétiques
La flunarizine est bien absorbée à partir de l'intestin.

Les concentrations sanguines maximales sont obtenues 2 à 4 heures après la prise.
Les taux plasmatiques"steady state" sont atteints après 5 à 6 semaines. La liaison
aux protéines plasmatiques (90 %) et le volume de distribution (43,2 l/kg) sont
appréciables. La demi-vie d'élimination (t1/2ß) est de 18 jours. Après métabolisation
dans le foie, l'excrétion se fait principalement par voie fécale (excrétion biliaire),
tandis qu'une très petite quantité seulement (< 0,1 %) est excrétée par voie urinaire.
6. DONNEES PHARMACEUTIQUES
6.1 Liste des excipients
lactose, amidon de maïs, hypromellose, polysorbate, cellulose microcristalline,
croscarmellose sodique, silice colloïdale anhydre et stéarate de magnésium.
6.2 Incompatibilités
Non applicable
6.3 Durée de conservation
3 ans
6.4 Précautions spéciales de conservation
A conserver dans l’emballage d’origine à l’abri de la lumière.
6.5 Nature et contenu de l’emballage
emballage de 28 comprimés.
6.6 Précautions particulières d’élimination
Pas d’exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
Janssen-Cilag s.a.
Antwerpseweg 15-17
B-2340 Beerse
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
BE109821
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE
L’AUTORISATION
01/03/1978
10. DATE DE MISE A JOUR DU TEXTE
08/2010
Date de l’approbation du RCP : 31/03/2015
1
/
4
100%