IL-12 et IFN-γ - iPubli

L
e genre Mycobacterium, com-
prend des bactéries aérobies
qui ont une paroi très particu-
lière et riche en lipides [1].
De nombreuses espèces de
mycobactéries peuvent être distin-
guées, certaines responsables de mala-
dies communes comme M. leprae, res-
ponsable de la lèpre, mais aussi le
complexe Mycobacterium tuberculosis
comprenant M. tuberculosis, M. bovis, et
M. africanum responsables de la tuber-
culose chez l’homme, ou encore
M. ulcerans responsable de l’ulcère de
Buruli [2]. D’autres sont moins viru-
lentes, telles que les bacilles de Cal-
mette et Guérin (BCG), souches atté-
nuées de M. bovis [3], et couramment
utilisées pour la vaccination contre la
tuberculose et la lèpre, ou bien
encore les mycobactéries dites envi-
ronnementales, ou non tubercu-
leuses (MNT), et retrouvées de façon
ubiquitaire [4].
De nombreuses études chez la souris
ont permis de caractériser le rôle
indispensable des lymphocytes T,
des macrophages et de différentes
cytokines dans le développement
d’une immunité protectrice contre
les infections mycobactériennes [5].
En particulier, l’interaction de lym-
phocytes T CD4, et dans une
moindre mesure CD8, avec des
macrophages infectés, apparaît
déterminant pour l’élimination de
la mycobactérie [6]. Dans le cadre
de la réponse anti-mycobactérienne,
cette interaction est facilitée par la
mise en place de granulomes au
1112
SYNTHÈSE
médecine/sciences 2001 ; 17 : 1112-9
m/s n° 11, vol. 17, novembre 2001
IL-12 et IFN-
γ
:
un axe clé de l’immunité
anti-mycobactérienne
chez l’homme
Les maladies mycobactériennes communes, la tuberculose,
la lèpre, et l’ulcère de Buruli, sont responsables d’une mor-
bidité et d’une mortalité considérables dans le monde. Les
autres mycobactéries, comme les souches vaccinales de Cal-
mette et Guérin (BCG) et les mycobactéries environnemen-
tales, sont moins virulentes chez l’homme mais peuvent
être responsables d’infections sévères si la réponse immu-
nitaire est imparfaite. Chez l’homme, l’étude du syndrome de
prédisposition mendélienne aux infections mycobacté-
riennes, a permis d’établir le rôle clé de l’interféron-γ(IFN-γ),
mais également de son principal inducteur l’interleukine-12
(IL-12), dans les mécanismes moléculaires de l’immunité
anti-mycobactérienne. Le rôle de cet axe dans la vulnérabi-
lité aux infections mycobactériennes communes peut à pré-
sent être testé.
ADRESSE
F. Altare, J.L. Casanova : Laboratoire de
génétique humaine des maladies infec-
tieuses, Unité mixte de recherche, Univer-
sité de Paris René-Descartes-Inserm U. 550,
Faculté de médecine Necker, 156, rue de
Vaugirard, 75015 Paris, France.
E-mail : [email protected]
Frédéric Altare
Jean-Laurent Casanova

1113
m/s n°11, vol. 17, novembre 2001
niveau du site infectieux. Il s’agit de
structures multicellulaires compo-
sées de lymphocytes, de macro-
phages infectés, de cellules épithé-
lioïdes et de cellules géantes de
Langhans issues respectivement de
la différenciation et de la fusion de
macrophages. Ces granulomes se
forment en particulier grâce au
recrutement de lymphocytes au
cours de la réaction inflammatoire
consécutive à l’infection [7]. Parmi
les cytokines participant à l’interac-
tion lymphocyte/macrophage, le
rôle déterminant de l’IL-12, mais
également de l’IFN-γet du TNF-α, a
été clairement démontré chez la
souris. En effet, les souris dont les
gènes de ces trois cytokines ou de
leurs récepteurs ont été invalidés
sont très vulnérables aux infections
mycobactériennes, et ne dévelop-
pent pas de granulomes [5].
Chez l’homme, le rôle des lympho-
cytes T dans l’immunité anti-myco-
bactérienne a également été constaté.
Les individus présentant un déficit
lymphocytaire T majeur, acquis [8],
ou héréditaire [9], sont en effet très
sensibles aux infections mycobacté-
riennes. Une sensibilité comparable a
également été constatée chez les indi-
vidus présentant un déficit des phago-
cytes [9]. En revanche, à la différence
du système murin, une coopération
cellulaire impliquant les lymphocytes
T, et aboutissant à l’activation des
mécanismes de destruction intracellu-
laire des mycobactéries par les macro-
phages infectés n’a jamais été claire-
ment démontrée chez l’homme [5].
L’étude récente de patients présen-
tant un syndrome de prédisposition
mendélienne aux infections mycobac-
tériennes (MIM 209950), a permis de
mieux caractériser les mécanismes
moléculaires de l’immunité anti-
mycobactérienne chez l’homme. Ces
patients ont une vulnérabilité hérédi-
taire aux infections mycobacté-
riennes, et dans une moindre mesure
aux salmonelles, en l’absence de tout
déficit immunitaire connu [10, 11].
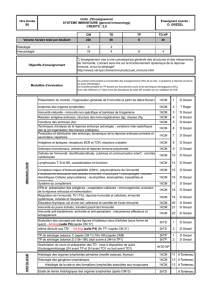
La caractérisation moléculaire de ces
patients a permis d’identifier des défi-
cits dans cinq gènes participant aux
voies d’activation cellulaire par l’IFN-
γou l’IL-12 (figure 1), mettant ainsi en
évidence le rôle indispensable de
l’IFN-γet de son principal inducteur,
l’IL-12 dans le contrôle des infections
mycobactériennes chez l’homme.
Mycobacterium
STAT-1
IFN-γR1
2
IL-12 IL-12R β1
β2
STAT-4
IFN-γ
p35
p40
Phagocyte/cellule dendritique Lymphocyte T/NK
Figure 1. Étiologie génétique du syndrome de prédisposition mendélienne
aux infections mycobactériennes. La coopération entre les cellules sécrétant
l’IL-12 (macrophages et cellules dendritiques) et les cellules sécrétrices d’IFN-
γ
(lymphocytes T et NK) est représentée. Les molécules dont les gènes pré-
sentent des mutations prédisposant aux infections mycobactériennes sont
représentées en rouge. L’infection de macrophages/cellules dendritiques par
une mycobactérie induit la transcription des gènes codant pour l’IL-12 p40 et
p35. Les polynucléaires neutrophiles qui sécrètent également de l’IL-12 ne
sont pas représentés. L’IL-12 induit la transcription du gène codant pour
l’IFN-
γ
qui peut soit activer les macrophages/cellules dendritiques via l’hété-
rodimère IFN
γ
R1/ IFN
γ
R2, soit activer les lymphocytes T/NK de façon auto-
crine.
Rôle de l’immunité
induite par l’IFN-
γ
L’IFN-γest une cytokine homodimé-
rique produite principalement par
les lymphocytes T et NK. Son récep-
teur, qui est exprimé par la majorité
des types cellulaires, se compose
d’une chaîne α(ou IFN-γR1), qui
permet la fixation de l’IFN-γ, et
d’une chaîne β(ou IFN-γR2) ne
jouant pas directement de rôle dans
la fixation du ligand, mais qui per-
met la transduction du signal [12].
Les deux chaînes IFN-γR1 et IFN-γR2
sont constitutivement associées à
deux kinases, JAK1 et JAK2 respecti-
vement, au niveau de leur domaine
intracellulaire (figure 2). Lors de la
fixation de l’IFN-γ, il y a rapproche-
ment des deux chaînes du récepteur
entraînant la phosphorylation réci-
proque de JAK1 et JAK2, ainsi que la
phosphorylation du site de fixation
de la molécule STAT1 sur la chaîne
IFN-γR1. Cette fixation entraîne la
phosphorylation de la molécule
STAT1 qui s’homodimérise, formant
ainsi le complexe GAF, et traverse la
paroi nucléaire pour aller se fixer sur
les sites GAS (IFN-γactivation
sequence) au niveau des promoteurs
des gènes inductibles par l’IFN-γ[12]
(figure 2).
Différentes mutations responsables
d’un défaut complet de la chaîne
IFN-γR1 [13-19], et une mutation
entraînant un défaut complet de la
chaîne IFN-γR2 [20], ont été identi-
fiées chez des individus présentant le
syndrome de prédisposition mendé-
lienne aux infections mycobacté-
riennes. A l’échelle cellulaire, ces
différentes mutations sont respon-
sables d’une perte totale de réponse
à l’IFN-γ. Sur le plan clinique, tous
les patients atteints d’un défaut com-
plet des molécules IFN-γR1 ou IFN-
γR2, ont développé des infections
sévères par le BCG ou les mycobacté-
ries environnementales, et présenté
des structures granulomateuses mal
circonscrites et peu différenciées.
Comme chez la souris, l’IFN-γparaît
donc avoir un rôle indispensable
dans l’immunité anti-mycobacté-
rienne et dans la formation de gra-
nulomes chez l’homme. De plus, les
patients présentant un défaut com-
plet des molécules IFN-γR1 ou IFN-
γR2 ont des taux élevés d’IFN-γdans
le sérum. Ce résultat est probable-
ment dû à une accumulation de
l’IFN-γproduit en réponse à l’embal-

lement de l’infection mycobacté-
rienne, et qui ne peut pas être capté
par les cellules de ces patients qui
ont un récepteur non fonctionnel
[21]. Cette caractéristique apparaît
également très intéressante d’un
point de vue clinique, puisqu’elle
permet un diagnostic rapide des
défauts complets en récepteur de
l’IFN-γ, par simple dosage sérique de
la cytokine.
Des défauts partiels, récessifs [22, 23]
ou dominants [24, 25] de l’IFN-γR1,
mais également un défaut partiel
récessif de l’IFN-γR2 [26], entraînant
une diminution de la réponse cellu-
laire à l’IFN-γ, ont été identifiés chez
d’autres individus présentant le syn-
drome. Ces patients ont un phéno-
type clinique atténué, caractérisé par
des infections curables et la présence
de granulomes bien différenciés. Ces
résultats indiquent qu’il existe une
forte corrélation entre le génotype et
le phénotype cellulaire et clinique
chez les individus atteints de ce syn-
drome. Les infections mycobacté-
riennes sont sévères chez les indivi-
dus présentant des défauts complets
d’activation par l’IFN-γ, et plus
modestes chez les patients présentant
des défauts partiels d’activation par
l’IFN-γ. Il apparaît, de plus, une
grande hétérogénéité allélique dans
les défauts en IFN-γR1, avec trois
formes récessives (défaut complet
avec expression, défaut complet sans
expression, défaut partiel) et une
forme dominante (défaut partiel
avec accumulation d’une molécule
IFN-γR1 non fonctionnelle) (figure 3).
Plus récemment un défaut partiel de
la molécule STAT1 a été identifié
chez deux patients présentant une
forme atténuée du syndrome, et
aucun défaut des molécules IFN-γR1
ou IFN-γR2. Du point de vue clinique
et physiopathologique, ils ressem-
blent aux patients présentant un
défaut partiel d’une des deux sous-
unités du récepteur de l’IFN-γ, avec
une infection finalement maîtrisée,
et une réponse partielle à l’IFN-γ
[27]. Cette mutation bloque la phos-
phorylation de la protéine STAT1 en
réponse à l’IFN-γ, ce qui entraîne un
défaut de translocation nucléaire de
l’homodimère activateur STAT1/
STAT1 (GAF) [27]. Seul le quart des
dimères STAT1 qui peuvent se for-
mer sont fonctionnels chez ces deux
patients, entraînant ainsi un défaut
partiel de réponse à l’IFN-γ. Au plan
immunologique, ce déficit immuni-
taire affectant un des médiateurs de
l’immunité induite par l’IFN-γ, sou-
ligne encore une fois le rôle indis-
pensable de l’IFN-γdans la réponse
anti-mycobactérienne. Il démontre
de plus que le contrôle des infections
mycobactériennes est non seulement
dépendante de l’IFN-γ, mais égale-
ment que les mécanismes induits par
l’IFN-γpassent par l’activation du fac-
teur de transcription STAT1 dans le
cadre des dimères GAF.
L’immunité induite par l’IFN-γest
donc un trait quantitatif qui déter-
mine l’issue d’une invasion mycobac-
térienne chez l’homme [28]. Cela
suggère qu’il n’existe pas de voie
alternative à l’activation cellulaire
par l’IFN-γ. Bien qu’il soit difficile de
déterminer la fonctionalité des gra-
nulomes chez les patients présentant
un défaut partiel, il semble cepen-
dant incontestable que la formation
d’un granulome bien différencié soit
insuffisante au contrôle total de
l’infection mycobactérienne. Plu-
sieurs questions restent cependant en
suspens. Le récepteur de l’IFN-γ
étant ubiquitaire, il est difficile de
savoir quelles sont la ou les cellules
responsables du phénotype clinique
chez ces patients. De même, il est dif-
ficile à ce stade de déterminer la (ou
les) fonction(s) induite(s) par l’IFN-
γ, et dont le défaut est responsable
de l’absence de granulomes bien dif-
férenciés. Contrairement à la souris,
l’immunité induite par l’IFN-γ
semble, chez l’homme, uniquement
consacrée au contrôle des infections
mycobactériennes, aucune sensibilité
particulière à d’autres pathogènes
n’ayant jamais été décrite chez ces
patients [29].
1114 m/s n°11, vol. 17, novembre 2001
IFN-γ
R1 R1
R2 R2 Membrane
plasmique
JAK2
JAK1
JAK2
JAK1
Paroi
nucléaire
STAT1/STAT1
(GAF)
GAS
Figure 2. Voie de signalisation de l’IFN-
γ
.La fixation de l’homodimère IFN-
γ
à
son récepteur induit le rapprochement de deux kinases (JAK1/JAK2) consti-
tutivement associées aux deux chaînes du récepteur. Ce rapprochement per-
met l’activation de ces kinases qui induisent la formation d’un homodimère
STAT1 (complexe GAF) qui est transloqué dans le noyau cellulaire où il se
fixe à un site spécifique (GAS), induisant la transcription génique.

1115
m/s n°11, vol. 17, novembre 2001
Rôle de l’immunité
induite par l’IL-12
L’IFN-γ, et les molécules impliquées
dans la réponse cellulaire à cette
cytokine étant indispensables à
l’immunité anti-mycobactérienne, un
rôle des molécules activatrices de la
production d’IFN-γ, et en particulier
de l’IL-12, a donc été recherché chez
les patients présentant le syndrome
et aucune altération de l’immunité
induite par l’IFN-γ. L’IL-12 est une
cytokine hétérodimérique composée
de deux chaînes (p35 et p40). Princi-
palement sécrétée par les cellules
dendritiques et les phagocytes, sa
principale fonction apparaît être
l’induction de la production d’IFN-γ
[30]. Son récepteur, présent sur les
lymphocytes T et NK activés (figure 4),
se compose de deux chaînes (IL-
12Rβ1 et IL-12Rβ2).La co-expression
de ces deux chaînes est nécessaire à
la fixation de haute affinité de l’IL-12
[31]. Deux kinases appartenant à la
famille des Janus kinases (JAK) sont
associées aux chaînes IL-12Rβ1 et IL-
12Rβ2, il s’agit respectivement de
Tyk2 et de Jak2 [32] (figure 4). La
fixation de l’IL-12 à son récepteur
entraîne la phosphorylation de ces
kinases, qui phosphorylent à leur
tour le site de liaison de la molécule
STAT4 sur le récepteur [33]. La fixa-
tion de l’IL-12 à son récepteur
entraîne l’activation de trois molé-
cules STAT : STAT1, STAT3 et
STAT4, mais seule STAT4 est activée
directement via le récepteur de l’IL-
12 [34]. La molécule STAT4 activée
est dimérisée et transloquée dans le
IFN-γR1 mutésIFN-γR1
Extracellulaire
Intracellulaire
Transmission
Expression de surface
Fixation de l’IFN-γ
Défaut de signalisation
AD
+++
+
partiel
AR
+
+/- ?
partiel
AR
+
-
complet
AR
-
-
complet
Figure 3. Hétérogénéité allélique des défauts en IFN-
γ
R1. Une molécule IFN-
γ
R1 normale est représentée sur la gauche (IFN-
γ
R1), avec ses domaines
extracellulaire, trans-membranaire et intracellulaire. Les barres horizontales
dans la partie intracellulaire représentent les sites de fixation de JAK1 et
STAT1, et le site de recyclage du récepteur. Quatre types de mutants sont
représentés. De gauche à droite: le premier mutant est dépourvu de la majo-
rité du domaine intracellulaire, le second fixe probablement l’IFN-
γ
avec une
faible affinité, le troisième ne fixe pas l’IFN-
γ
, et le dernier n’est pas exprimé
à la surface cellulaire en raison d’un codon stop situé avant le domaine
transmembranaire. Ces mutations définissent ainsi quatre types de défauts
en IFN-
γ
R1 différents en termes: de transmission (autosomique dominant,
AD; autosomique récessif, AR), de taux d’expression de molécule IFN-
γ
R1 à
la surface cellulaire (+++: accumulation; +: expression normale ; –:défaut
d’expression), de capacité de fixation de 125I-IFN-
γ
(+: normal; +/–?: proba-
blement affecté mais non aboli; -: aboli), et de défaut de signalisation induite
par l’IFN-
γ
(partiel, réponse affectée mais non nulle, complet, défaut complet
de réponse).
noyau où elle active la transcription
du gène IFNG [35].
Des patients présentant des défauts
complets en IL-12 p40 [36] ou en IL-
12Rβ1 [37-41], ont été identifiés.
Comme chez la souris, le phénotype
clinique et histologique de ces
patients est plus atténué que celui
des patients présentant un défaut
complet de la voie d’activation par
l’IFN-γ, avec des infections traitées
par antibiothérapie seule, ou antibio-
thérapie et IFN-γ. Ces patients sont
ainsi plutôt comparables aux indivi-
dus présentant un défaut partiel
d’activation par l’IFN-γ, avec la for-
mation de granulomes bien circons-
crits et bien différentiés [38, 39].
Bien que des granulomes bien diffé-
renciés soient présents, il semble que
leur cinétique d’apparition soit retar-
dée en absence d’activation par l’IL-
12. En effet, des biopsies effectuées
peu après l’infection montraient des
régions dépourvues de granulomes
différenciés chez la patiente présen-
tant un défaut complet en IL-12 p40,
alors que de nombreux granulomes
bien différenciés étaient visibles sur
une biopsie effectuée plus tardive-
ment sur la même patiente [36]. De
façon comparable aux patients pré-
sentant un défaut d’activation cellu-
laire par l’IFN-γ, et à la différence des
souris déficientes dans cette même
voie d’activation, ces patients ont une
sensibilité qui se limite aux infections
mycobactériennes, à l’exception de
quelques infections par Salmonella.
Au niveau immunologique, le princi-
pal défaut constaté chez ces patients
est une forte diminution de la pro-
duction d’IFN-γpouvant être complé-
mentée in vitro, et de façon dépen-
dante de la dose par ajout d’IL-12
recombinante, confirmant le lien de
cause à effet entre le défaut géné-
tique d’IL-12, et la diminution de
production d’IFN-γ. La production
résiduelle d’IFN-γpar des lympho-
cytes T et NK de ces patients activés
in vitro, rend vraisemblablement
compte de leur phénotype clinique
atténué, comme le montre égale-
ment l’effet bénéfique du traitement
par l’IFN-γdes patients [42]. Une
incertitude demeure cependant sur
le type cellulaire responsable de cette
production résiduelle d’IFN-γ. Seule
l’identification de défauts complets
du récepteur de l’IL-12 affectant spé-
cifiquement soit les lymphocytes T,

soit les NK, permettrait de discrimi-
ner leur participation relative à cette
production d’IFN-γ.
Une famille dont un enfant présen-
tait un défaut complet en IL-12Rβ1,
et a développé une infection dissémi-
née par le BCG consécutive à sa vac-
cination, a récemment été étudiée.
De façon inattendue, une de ses
sœurs qui présentait la même muta-
tion homozygote du gène IL12RB1, a
résisté à trois vaccinations par le BCG
à différents âges [41]. L’étude de
cette patiente semble indiquer, qu’à
la différence des individus présentant
un défaut d’activation cellulaire par
l’IFN-γ, il n’y a pas de corrélation
phénotype/génotype dans les défauts
d’activation par l’IL-12. En effet,
cette observation démontre que des
mécanismes indépendants de l’IL-12
peuvent, dans certains cas, suffire au
contrôle des infections par des myco-
bactéries peu virulentes comme le
BCG. De façon intéressante, cette
patiente a développé à l’adolescence
une péritonite tuberculeuse, une
forme rare et particulièrement sévère
d’infection par M. tuberculosis [43].
L’immunité indépendante de l’IL-12
apparaît ainsi insuffisante pour le
contrôle de l’infection par des myco-
bactéries plus virulentes comme
M. tuberculosis [41].
Les mécanismes rendant compte de
cette hétérogénéité inter- et intrafa-
miliale des déficits en IL-12Rβ1 ne
sont pas clairs. Une variabilité des
facteurs environnementaux et une
variabilité des souches vaccinales uti-
lisées chez ces deux enfants ne peu-
vent pas être exclues, mais sont diffi-
cilement analysables a posteriori. Le
rôle de variations inter-individuelles
de la production d’IFN-γrésiduelle
qui serait, comme cela a été propo-
sée par certains auteurs, induite par
l’IL-12, mais indépendante de l’IL-
12Rβ1 [44], semble peu probable,
puisque le phénotype clinique n’est
pas moins sévère que chez les
patients présentant un défaut en IL-
12 p40. Il paraît plus vraisemblable
que ces variations soient dues à une
hétérogénéité de la production
d’IFN-γ, indépendante de l’IL-12, ou
bien à une hétérogénéité de réponse
cellulaire à l’IFN-γ, bien que ces
hypothèses restent à démontrer.
A la différence de la souris, chez
laquelle le rôle indispensable de
l’axe IFN-γ/IL-12 dans le contrôle de
l’infection par M. tuberculosis avait été
clairement démontré, seuls des argu-
ments indirects plaidaient en faveur
d’un rôle de ces deux cytokines dans
l’immunité contre la tuberculose
chez l’homme. En particulier, le rôle
de l’immunité induite par l’IL-12
dans la réponse à la tuberculose chez
l’homme avait seulement été suggéré
dans des études sur la production
d’IL-12 [45] et l’expression de son
récepteur [46] au niveau du site de
l’infection par M. tuberculosis. Cepen-
dant, aucun lien de cause à effet
n’avait pu être établi entre l’expres-
sion de cette cytokine et de son
récepteur au niveau du site infec-
tieux, et l’immunité anti-tubercu-
leuse. Grâce à l’étude de patients
présentant le syndrome de prédispo-
sition mendélienne aux infections
mycobactériennes, un rôle de l’IFN-γ
avait déjà été évoqué par l’étude
d’un premier patient présentant un
défaut partiel de l’IFN-γR1, qui avait
développé les symptômes d’une
tuberculose clinique primaire [22].
Ce malade n’avait pas été vacciné par
le BCG, ce qui le rend difficilement
comparable à la patiente ayant déve-
loppé une péritonite tuberculeuse
[41]. La caractérisation de ces deux
patients apporte la première
démonstration de l’importance de
l’immunité induite par l’axe IL-
12/IFN-γdans le contrôle de l’infec-
tion par M. tuberculosis chez l’homme
[41].
Conclusions
L’identification et la caractérisation
de patients présentant différentes
mutations dans les gènes IFNGR1,
IFNGR2, STAT1, IL12B, et IL12RB1 a
permis de démontrer le rôle essentiel
de l’immunité induite par l’IFN-γ,
dépendante de l’IL-12, dans le
contrôle des infections mycobacté-
riennes chez l’homme. L’efficacité
de l’activation cellulaire induite par
l’IFN-γapparaît directement propor-
1116 m/s n°11, vol. 17, novembre 2001
IL-12
Membrane
plasmique
Paroi
nucléaire
p35 p40
JAK2
TYK2
IL-12Rβ1 IL-12Rβ2
STAT4/STAT4
Figure 4. Voie de signalisation de l’IL-12. La fixation de l’hérérodimère IL-12
à son récepteur induit l’activation de deux kinases (TYK2/JAK2) constitutive-
ment associées aux deux chaînes du récepteur, permettant ainsi la formation
d’un homodimère STAT4. Cette activation entraîne la translocation nucléaire
du dimère STAT4, et sa fixation au niveau du promoteur de gènes induc-
tibles par l’IL-12.
 6
6
 7
7
 8
8
1
/
8
100%