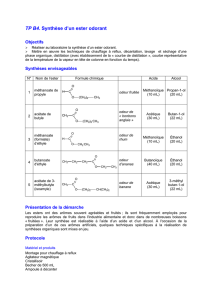
SC3bis-synthèse ester

SC3. Synthèse d’un ester odorant
Objectifs
Réaliser au laboratoire la synthèse d’un ester odorant.
Mettre en œuvre les techniques de chauffage à reflux, décantation, lavage et séchage d'une phase organique, distillation.
Protocole
Matériel et produits
Montage pour chauffage à reflux
Montage de distillation avec thermomètre
Béchers de 100 et 200 mL
Ampoule à décanter
Pipette graduée 1 mL
Eprouvettes graduées de 25 et 50 mL
Acide éthanoïque et 3-méthylbutan-1-ol
Acide sulfurique concentré
Solution d'hydrogénocarbonate de sodium à 10% (10g
de NaHCO
3
pour 100 mL)
Sulfate de magnésium anhydre
Données physico-
chimiques M (g.mol
-1
) densité à 20°C
θ
fus
(°C)
sous 1,013 bar
θ
éb
(°C)
sous 1,013 bar Solubilité dans
l'eau
acide éthanoïque 60 1,05 16,6 118 infinie
3-méthylbutan-1-ol 88 0,81 -117 128,5 faible (27 g/L)
acétate de 3-méthylbutyle 130 0,87 -78,5 142 faible (16 g/L)
Mode opératoire
Première étape : synthèse de l'éthanoate de butyle (estérification)
Dans le ballon, introduire: 22 mL de 3-méthylbutan-1-ol, 30 mL d'acide éthanoïque, 1 mL environ d'acide sulfurique
concentré et quelques billes de verre.
Chauffer à reflux (au minimum 30 min) à l’aide d’un chauffe-ballon.
Laisser refroidir le ballon à l’air libre puis sous un courant d’eau froide.
Deuxième étape : séparation de l'ester, lavage et séchage de la phase organique
Séparation
Après refroidissement, verser le contenu du ballon dans un grand becher contenant environ 100 mL d'eau distillée ;
agiter avec une baguette de verre.
Séparer les deux phases liquides à l'aide d'une ampoule à décanter et éliminer la phase aqueuse.
Lavage de la phase organique
Ajouter peu à peu à la phase organique, dans l'ampoule à décanter, environ 30 mL de solution
d'hydrogénocarbonate de sodium: on observe immédiatement un fort dégagement gazeux.
Après un dégazage progressif et une nouvelle décantation, éliminer la phase aqueuse.
Séchage de la phase organique
Récupérer la phase organique dans un petit bécher et la sécher à l’aide de sulfate de magnésium anhydre ; verser
le liquide surnageant dans une éprouvette propre et sèche. Mesurer le volume obtenu: V
1
.
Troisième étape : "rectification" de l'ester ou distillation
L'ester obtenu à la fin de l'étape précédente est le "produit brut".
Pour purifier l’ester, on procède à une distillation fractionnée de la phase organique obtenue précédemment.
Questions
1. Faire un schéma du dispositif de chauffage à reflux en indiquant le nom des pièces de verrerie.
2. Ecrire l’équation de la réaction d'estérification.
3. Pourquoi réalise-t-on la réaction à chaud ?
4. Quel est le rôle de l'acide sulfurique dans cette opération?
5. Faire un schéma de l'ampoule à décanter et identifier les différentes phases lors de la 1
ère
décantation. Justifier.
6. Quelle est la nature du gaz formé lors de l’opération de lavage de la phase organique ? Ecrire l’équation de la
réaction (réaction avec des ions hydrogénocarbonate,
-
3
HCO
). Quel est le rôle de ce traitement?
7. A l'aide du tableau des données physico-chimiques, calculer les masses et les quantités de matière de chacun
des réactifs. Dire s'il y a un réactif en excès et si oui, lequel ?
8. Quelle est la masse théorique maximale d’ester que l’on peut obtenir ? (c'est à dire pour un avancement maximal
de la réaction d'estérification)
9. Quelle est la masse d’ester brut obtenue (à la fin de la deuxième étape) ? En déduire le rendement brut de la
synthèse de l'éthanoate de 3-méthylbutyle.
10. Faire un schéma du dispositif de distillation en indiquant le nom des pièces de verrerie ; que contient le ballon
au début de la distillation?
Décrire le principe de la distillation fractionnée. Expliquer comment on peut recueillir l'ester pur.
1
/
1
100%