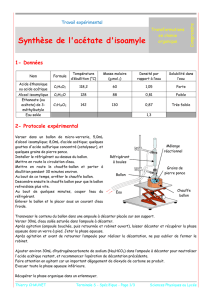
huile essentielle de jasmin

Page 1 sur 2
Synthèse d’un ester : l’éthanoate de benzyle
Introduction : L’éthanoate de benzyle ou acétate de benzyle est un ester présent dans l'huile essentielle de jasmin (environ
20% de l'absolue de jasmin). Cet ester est utilisé en parfumerie.
I. DONNEES
1) Risques inhérents aux produits :
Acide éthanoïque (acétique) pur : très corrosif, provoque de graves brûlures, réaction très exothermique avec l’eau.
Alcool benzylique : nocif par inhalation des vapeurs et par absorption.
Ethanoate de benzyle : inflammable, vapeurs irritantes pour les voies respiratoires.
2) Caractéristiques des espèces chimiques utilisées
Masse molaire
(g/mol)
Densité à 20°C
Solubilité dans l’eau
Solubilité dans l’eau
salée
Acide éthanoïque
60
1,05
infinie
infinie
Alcool benzylique
108
1,05
faible
Plus faible que dans l’eau
Ethanoate de
benzyzle
150
1,06
Très faible
insoluble
Formule Alcool
benzylique
C6H5-CH2OH
Eau salée saturée
Densité : 1,2
Couple acido-basique
H2O,CO2/ HCO3-
II. PRINCIPE DE LA SYNTHESE
L'estérification est une réaction lente.
Pour accélérer l’estérification on élève la température et on ajoute un catalyseur au milieu réactionnel
On fait agir l'acide éthanoïque (acétique) sur l'alcool benzylique , écrire en formule semi développée
l’équation de la réaction d’estérification.
III. PROTOCOLE EXPERIMENTAL
3) Synthèse de l’ester
1. Dans le ballon verser dans l’ordre 30 mL d’acide éthanoïque ,1O goutes d’acide sulfurique concentré et 20 mL
d’alcool benzylique (volumes mesurés à l’éprouvette graduée) .
2. Ajouter une bille.
3. Adapter le réfrigérant à reflux (voir schéma) et mettre le chauffage en route. L’ébullition doit être douce. Observer
l’évolution des vapeurs dans le réfrigérant, il faut que la condensation des vapeurs se fasse dans le tiers inférieur de la
colonne. Chauffer à reflux pendant 30 minutes. (répondre aux questions pendant cette durée)
4. Au bout de 30 min couper l’alimentation du chauffe ballon,
5. Laisser refroidir le ballon dans l’air ambiant : en abaissant le support élévateur. Maintenir la circulation d’eau.
6. Puis le refroidir en le passant sous l’eau froide.

Page 2 sur 2
4) Séparation et purification de l’ester
1) Verser le contenu du ballon dans une ampoule à décanter
2) Rincer le ballon en y versant 50 mL d’une solution saturée de chlorure de sodium
3) Vider cette eau de rinçage dans l’ampoule à décanter
4) Agiter l’ampoule afin de favoriser le lavage de la phase organique.
5) Laisser décanter
6) L’ampoule contient deux phases. Les identifier (compléter le schéma ci-contre). Justifier
7) Donner la composition des deux phases.
8) Eliminer la phase aqueuse avec précision. Garder la phase organique.
9) Ajouter 50 mL d’une solution d’hydrogénocarbonate de sodium sans remettre le bouchon.
Lorsque le dégagement gazeux devient faible remettre le bouchon et agiter afin de faciliter le lavage de la phase
organique
10) Retourner l’ampoule et ouvrir le robinet afin de laisser échapper les gaz.
11) Reposer l’ampoule sur son support et évacuer la phase aqueuse avec précision
12) Récupérer la phase organique S dans une éprouvette
noter le volume V = mL
13) Donner la composition de S
IV. QUESTIONS
1) Déterminer la composition du mélange initial. Est-il équimolaire ?
2) Dresser un tableau d’avancement et déterminer la masse d’ester que l’on pourrait obtenir si la réaction était totale.
3) Déterminer la masse d’ester obtenue expérimentalement. On supposera que le produit de la synthèse n’est que de
l’ester.
4) Quelle est la classe de l’alcool benzylique ?
5) Quel est le rôle de l’eau salée ?
6) Quel est le rôle de l’hydrogénocarbonate de sodium ? Ecrire l’équation de la réaction. En déduire la nature du gaz
apparu
r
Montage à reflux
Questions :
1) Légender le schéma ci-contre.
2) Quel est le rôle du chauffage ?
3) Que se passerait-il si le réfrigérant à eau n’existait
pas ?
4) En déduire le rôle du chauffage à reflux.
5) Quel est le rôle de l’acide sulfurique.
1
/
2
100%