Amylose et rythme cardiaque

MISE AU POINT
La Lettre du Cardiologue - n° 344 - avril 2001
32
INTRODUCTION
L’amylose est un diagnostic anatomopathologique montrant des
dépôts extracellulaires de fibrilles colorées en vert pomme biré-
fringent par le rouge Congo. Ces dépôts conduisent à une perte
de l’architecture normale et à des anomalies fonctionnelles
variables selon les organes. Quatre types d’amylose sont claire-
ment définis selon l’étiologie :
✔L’amylose AL, compliquant les myélomes. Les dépôts sont
faits de chaînes légères λou κ. Le pronostic de l’atteinte car-
diaque dans cette forme est effroyable, les patients décédant
d’insuffisance cardiaque réfractaire ou de trouble rythmique.
✔La neuropathie amyloïde familiale (FAP) est due à une muta-
tion de la transthyrétine [TTR] ( préalbumine) produite par le
foie. Cette protéine normalement soluble est rendue insoluble et
se dépose dans divers organes. Actuellement, environ 80 muta-
tions sont répertoriées, avec divers foyers dans le monde (Portu-
gal, Nord de la Suède, Japon...). La transplantation hépatique
permet d’améliorer le pronostic de ces patients et de diminuer la
vitesse d’évolution de la neuropathie (1, 2).
✔L’amylose AAcomplique les états inflammatoires chroniques,
polyarthrite rhumatoïde, maladie de Crohn en Europe de l’Ouest
et aux États-Unis, tuberculose et lèpre dans les pays du tiers-
monde. L’insuffisance rénale est prédominante dans cette forme,
alors que la neuropathie périphérique et l’atteinte cardiaque sont
très rares.
✔L’amylose sénile est une atteinte cardiaque du vieillard faite
de dépôts de TTR normale. Elle se présente sous forme d’insuf-
fisance cardiaque congestive ou de fibrillation auriculaire avec
dyspnée et asthénie. Le pronostic est meilleur que celui de l’amy-
lose AL. Il n’y a pas de traitement spécifique de cette forme
d’amylose.
C’est dans les deux premières formes que les troubles du rythme
ont été correctement documentés.
TROUBLE DU RYTHME DANS L’AMYLOSE AL
L’atteinte cardiaque dans cette forme d’amylose est de l’ordre de
30 à 50 %. Le diagnostic peut être affirmé par l’existence d’une
hypertrophie ventriculaire gauche à l’échocardiographie avec
aspect feuilleté et hyperéchogène du septum interventriculaire.
Les biopsies cardiaques sont inutiles dans ce cas, car constam-
ment positives (3). Au plan électrocardiographique, on retrouve
un microvoltage, des ondes Q de pseudo-nécrose dans les déri-
vations précordiales et/ou inférieures. Les hémiblocs, blocs de
branche et bloc auriculo-ventriculaire sont fréquents. La mort
subite représente 30 à 50 % des décès d’origine cardiaque dans
cette population, mais il n’existe aucun marqueur de risque satis-
faisant.
Reisinger a réalisé, sur un effectif de 25 patients atteints
d’amylose AL, une exploration électrophysiologique complète
Amylose et rythme cardiaque
●
S. Dinanian*
* Hôpital Béclère, 157, rue de la porte-de-Trivaux, 92140 Clamart.
■
L’atteinte cardiaque des amyloses AL est générale-
ment très sévère et conditionne le pronostic vital. Le
décès est fréquemment subit, par trouble du rythme ou
incompétence myocardique. En cas de rémission du
myélome, une greffe cardiaque peut être envisagée.
■
Dans la neuropathie amyloïde familiale, les troubles
conductifs sont fréquents, témoins de l’atteinte car-
diaque.
■La transplantation hépatique permet d’améliorer le pro-
nostic vital et de ralentir le cours de la maladie.
■Pour la mutation méthionine 30, on a pu montrer une
évolution des troubles conductifs, malgré la transplan-
tation hépatique. Cela incite à la plus grande vigilance,
étant donné le haut risque de mort subite dans cette
population. Ainsi, la constatation d’une anomalie de la
conduction, avant ou après transplantation, justifie l’im-
plantation d’un stimulateur cardiaque définitif.
Mots-clés : Amylose cardiaque - Troubles du rythme -
Troubles de la conduction.
Points forts

La Lettre du Cardiologue - n° 344 - avril 2001
33
M
ISE AU POINT
afin de mieux cerner les causes éventuelles de ces morts subites
(4). Aucun des patients n’avait un ECG normal. Un BAV 1 était
retrouvé chez la moitié des patients, des ondes Q chez 64 %, un
hémibloc chez 32 %, un bloc de branche droit ou gauche chez
16 % (8 % BBD, 8 % BBG). Les mesures électrophysiologiques
endocavitaires ont mis en évidence des troubles conductifs
nodaux et infranodaux avec un intervalle AH moyen à 121 ms
± 33 ms (70 à 210) et un intervalle HV moyen à 79 ms ± 18 ms
(50 à 110). Chez 12 patients, il mesurait plus de 80 ms. En
revanche, la stimulation ventriculaire programmée n’a déclenché
une tachycardie ventriculaire soutenue que chez 3 patients . Tous
trois avaient des critères de positivité des potentiels tardifs. Deux
stimulateurs cardiaques et un défibrillateur ont été implantés chez
3 patients. Vingt-trois patients sont décédés ou ont bénéficié d’une
transplantation cardiaque :
●dix morts subites, incluant les trois patients appareillés,
●sept insuffisances cardiaques congestives,
●deux transplantations cardiaques pour insuffisance cardiaque
réfractaire,
●quatre décès non cardiaques.
En analyse univariée, on retrouve une relation entre mort subite
et intervalle HV ≥80 ms (p = 0,024). Toutefois, cela ne signifie
pas obligatoirement que la cause du décès soit un trouble conduc-
tif aigu. Un HV long serait le marqueur d’une infiltration sévère
majorant le risque d’arythmie ventriculaire fatale ou de disso-
ciation électromécanique.
Le haut risque de mort subite a conduit l’équipe du Medical Cen-
ter de Boston à proposer l’implantation d’un défibrillateur chez
11 patients présentant des troubles du rythme documentés (5).
Deux patients seulement ont survécu. Une dissociation électro-
mécanique primaire ou secondaire à des chocs appropriés était
responsable du décès .
Nous rapportons deux cas cliniques d’amylose AL ayant
conduit à poser l’indication de stimulation cardiaque défini-
tive.
✔Une femme de 43 ans est adressée pour bilan cardiologique
avant chimiothérapie intensive dans le cadre d’une amylose AL
compliquant un myélome à chaînes légères. Le tableau clinique
est celui d’une insuffisance cardiaque congestive en anasarque
résistant au traitement habituel. L’hypertrophie est modérée, avec
un septum mesurant 12 mm, mais sa structure est évocatrice avec
un aspect hyperéchogène. La fonction diastolique est très alté-
rée, avec intolérance au remplissage. La fonction systolique est
relativement conservée. Le holter va mettre en évidence une
hyperexcitabilité ventriculaire, une dysfonction sinusale avec
échappement jonctionnel et une variabilité sinusale effondrée.
Jugeant délétère la perte de la systole auriculaire dans un tel
tableau, l’indication de stimulation cardiaque est retenue. La
patiente décède pendant son hospitalisation de dissociation élec-
tromécanique, avant l’implantation d’un stimulateur, malgré les
manœuvres habituelles de réanimation.
✔Un homme de 60 ans, sans diagnostic d’amylose AL, se plaint
d’altération de l’état général avec perte de poids, toux non pro-
ductive à l’effort et à la parole. On retrouve des signes discrets
d’insuffisance cardiaque congestive. Le bilan cardiaque permet
de conclure à une cardiopathie hypertrophique avec septum mesu-
rant 17 mm, d’allure idiopathique. La coronarographie et les biop-
sies cardiaques sont normales. Le cathétérisme droit est en faveur
d’une restriction sévère. L’évolution est émaillée de troubles du
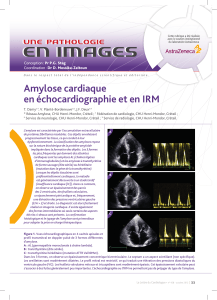
rythme auriculaire (figure 1) qui aggravent l’état hémodyna-
mique, ainsi que d’une dysfonction sinusale menant à l’indica-
tion d’un stimulateur cardiaque définitif associé à la prescription
d’amiodarone. Le seuil de stimulation atrial est très élevé et la
Figure 1. Patient atteint d’amylose AL. Tracé 12 dérivations. Dans les dérivations standards, le rythme est difficile à analyser et les complexes QRS sont
peu voltés. En revanche, les ondes de tachycardie atriale à 170/mn sont nettement visibles en V1. Elles conduisent spontanément en 3/1 vers les ventricules.

La Lettre du Cardiologue - n° 344 - avril 2001
34
M
ISE AU POINT
capture de l’oreillette ne s’accompagne d’aucune activité méca-
nique en échocardiographie. Le patient décède deux mois plus
tard d’insuffisance cardiaque. L’examen anatomopathologique
du cœur révèle la présence de pigments amyloïdes que les biop-
sies n’avaient curieusement pas retrouvés.
Dans ces deux observations, la présence de troubles du rythme
auriculaires et/ou ventriculaires concourt à l’aggravation du
tableau clinique. L’infiltration cardiaque s’accompagne d’une
hypertrophie plus ou moins marquée, sans corrélation avec la gra-
vité clinique. Le caractère restrictif est majeur dans les deux cas,
expliquant la mauvaise tolérance de l’arythmie. L’évolution est
rapidement fatale dans les deux cas.
TROUBLES DU RYTHME DANS LA NEUROPATHIE AMYLOÏDE
FAMILIALE
L’amylose familiale est caractérisée par une neuropathie péri-
phérique sensitivo-motrice associée à une dysautonomie touchant
le tractus gastro-intestinal, la vessie et le système cardiovascu-
laire. Les symptômes débutent généralement au cours de la
deuxième ou troisième décennie, plus tard pour certains
patients(6). Le décès survient 7 à 15 ans après le début des symp-
tômes. Dans cette forme d’amylose, la transplantation hépatique
peut améliorer le pronostic et ralentir la progression de la neuro-
pathie en supprimant la source de TTR anormale, essentiellement
produite par le foie (1, 2).
L’atteinte cardiaque est liée aux dépôts d’amylose et à la déner-
vation présynaptique responsable de troubles conductifs et d’ano-
malies de la compliance, alors que la fonction systolique est nor-
male (7-9).
La mutation méthionine 30 est la plus fréquente, notamment chez
les patients originaires du Portugal. Quatre-vingts mutations sont
connues actuellement. Elles ne semblent pas être toutes respon-
sables de la même forme clinique en ce qui concerne la date de
début des symptômes et la sévérité de l’atteinte cardiaque.
Les troubles du rythme auriculaire et ventriculaire sont rares
dans l’amylose familiale. Une équipe japonaise s’est récem-
ment intéressée à la comparaison des anomalies ECG des deux
formes d’amylose (FAP et AL) (10). On trouve significativement
moins d’arythmie par fibrillation auriculaire dans la FAP. Les
tachycardies ventriculaires recherchées par enregistrement hol-
ter sont de l’ordre de 10 % dans les deux groupes.
Sur une série de 55 patients hospitalisés pour bilan cardiaque
pré-transplantation hépatique, nous n’avons jamais observé
d’hyperexcitabilité ventriculaire notable sur les holters. De même,
les stimulations ventriculaires programmées n’ont jamais déclen-
ché de TV soutenue (protocole maximal, sans infusion d’isopré-
naline, un site stimulé) (11).
Lors de l’exploration électrophysiologique, on note l’existence
d’une voie lente chez 16 patients, mais aucun déclenchement de
rythme réciproque intranodal (figure 2). Un quart des patients
possède donc le substrat nécessaire à la formation de la réentrée
intranodale, mais ne déclenche aucune arythmie de ce type, faute
d’innervation favorable. En effet, l’étude des récepteurs sympa-
thiques post-synaptiques cardiaques par scintigraphie au MIBG
montre une dénervation importante comparée à un groupe de
témoins sains (8).
Les troubles conductifs sont très fréquents, tant à l’étage nodal
qu’infranodal. Un BAV 1 est présent chez 25 % des patients de
la série japonaise et de notre série (figure 3). Les blocs de branche
Figure 2. Patient atteint d’amylose familiale. Enregistrement de cinq dérivations de surface et d’une dérivation endocavitaire située sur la paroi latérale
de l’oreillette droite. Au début du tracé, on retrouve un BAV 1 avec intervalle PR mesurant 0,28 seconde. Vers la fin du tracé, sans modification du cycle
des ondes P, la conduction s’effectue brusquement par une voie beaucoup plus lente (PR = 0,48 seconde), avec amorce d’une période de Wenckebach témoi-
gnant de sa piètre conduction.

La Lettre du Cardiologue - n° 344 - avril 2001
35
M
ISE AU POINT
gauche sont deux fois plus fréquents que les blocs de branche
droite et sont retrouvés chez 10 à 30 % des patients. Les hémi-
blocs antérieurs gauches sont également fréquents (20 % des
patients), les hémiblocs postérieurs étant plus rares. Le HV moyen
mesure 59 ms ± 15 ms. Il est supérieur strictement à 55 ms dans
la moitié de notre population de FAP (figures 4a et 4b).
Les dysfonctions sinusales peuvent justifier un appareillage défi-
nitif par stimulateur cardiaque (9).
Le mode de décès des amyloses familiales est volontiers subit,
suggérant une origine rythmique. La transplantation hépatique
permet d’améliorer significativement le pronostic, mais n’élimine
pas totalement le risque de mort subite. La plus grande vigilance
est nécessaire dans le suivi cardiologique. On a pu observer une
évolution des troubles conductifs malgré la transplantation, en
particulier dans la forme MET 30 (12). Il nous semble justifié de
proposer un appareillage définitif par stimulateur cardiaque
devant la constatation d’un quelconque trouble conductif sur
l’ECG ou lors de l’exploration électrophysiologique. On s’écarte
alors des indications classiques de stimulation chez des patients
souvent asymptomatiques.
Figure 3.
Patient atteint d’amylose familiale.
Sur les quatre dérivations de surface,
les ondes P ne sont visibles que dans l’onde T
des trois premiers complexes.
Le rythme est sinusal, avec PR très long,
comme en témoigne l’enregistrement
endocavitaire de l’oreillette droite.
Figure 4a.
Patient atteint d’amylose familiale.
L’électrocardiogramme 12 dérivations
montre un BAV 1 et un bloc incomplet gauche.
Figure 4b. ➤
Enregistrement à 100/mn de trois dérivations
de surface et de deux dérivations endocavitaires
situées sur le faisceau de His.
L’intervalle AH mesure 250 ms,
mais le HV est également pathologique,
mesurant 80 ms. Chez ce patient, l’indication
d’un stimulateur cardiaque est retenue, malgré
l’absence d’antécédents de syncope.
▲

La Lettre du Cardiologue - n° 344 - avril 2001
36
M
ISE AU POINT
CONCLUSION
L’amylose est une pathologie rare qui touche de nombreux
organes, dont le cœur. Le pronostic diffère selon les étiologies :
il est très sombre dans l’amylose AL, pouvant justifier, en cas
de rémission du myélome, une transplantation cardiaque.
L’implantation d’un défibrillateur automatique ne permet pas
de prévenir la mort subite par dissociation électromécanique.
L’amylose familiale est responsable d’une atteinte cardiaque
moins sévère, pour laquelle les troubles conductifs justifient fré-
quemment la mise en place d’un stimulateur cardiaque prophy-
lactique. La transplantation hépatique permet une amélioration
du pronostic, sans toutefois interrompre complètement l’évolu-
tion de la maladie. ■
RÉFÉRENCES BIBLIOGRAPHIQUES
1. Holmgren G, Ericzon BG, Groth C et al. Clinical improvement and amyloid
regression after liver transplantation in hereditary transthyretin amyloidosis.
Lancet 1993 ; 341 : 1113-6.
2. Skinner M, Lewis D, Jones LA et al. Liver transplantation as a treatment for
familial amyloidotic polyneuropathy. Ann Intern Med 1994 ; 120 : 133-4.
3. Pellikka PA, Holmes DR, Edwards WD et al. Endomyocardial biopsy in
30 patients with primary amyloidosis and suspected cardiac involvement. Arch
Intern Med 1988 ; 148 : 662-6.
4. Reisinger J, Dubrey SW, Lavalley M, Skinner M, Falk RH. Electrophysiologic
abnormalities in AL (primary) amyloidosis with cardiac involvement. J Am Coll
Cardiol 1997 ; 30 : 1046-51.
5. Falk RH, Monahan K, Smith T. Failure of the implantable defibrillator to pre-
vent sudden death in cardiac amyloidosis. Europace (suppl.) 2000 ; 1 : D154.
6. Coelho T, Sousa A, Lourenco E, Ramalheira J. A study of 159 Portuguese
patients with familial amyloidotic polyneuropathy (FAP) whose parents were both
unaffected. J Med Genet 1994 ; 31 : 293-9.
7. Nakata T, Shimamoto K, Yonekura S et al. Cardiac sympathetic denervation in
transthyretin-related familial amyloidotic polyneuropathy : detection with iodine-
123-MIBG. J Nucl Med 1995 ; 36 : 1040-2.
8. Delahaye N, Dinanian S, Slama M et al. Cardiac sympathetic denervation in
familial amyloid polyneuropathy assessed by iodine-123 metaiodobenzylguani-
dine scintigraphy and heart rate variability. Eur J Nucl Med 1999 ; 26 : 416-24.
9. Eriksson P, Karp K, Bjerle P, Olofsson BO. Disturbances of cardiac rhythm
and conduction in familial amyloidosis with polyneuropathy. Br Heart J 1984 ;
51 : 658-62.
10. Hongo M, Yamamoto H, Kohda T, Takeda M et al. Comparison of electro-
cardiographic findings in patients with AL (primary) amyloidosis and in familial
amyloid polyneuropathy and anginal pain and their relation to histopathologic
findings. Am J Cardiol 2000 ; 85 : 849-53.
11. Dinanian S, Juin C, Delahaye N et al. Familial amyloidosis : cardiac infil-
tration and denervation. Pace 1999 ; 22 : 887.
12. Dinanian S, Moraru I, Juin C et al. Progression of conduction disturbances
after liver transplantation for familial amyloidosis. Pace 2000 ; 23 : 554.
1. Dans quelle forme d’amylose l’atteinte cardiaque a-t-elle le plus mauvais pronostic ?
2. L’implantation d’un défibrillateur automatique prévient-elle le risque de mort subite dans l’amylose AL ?
3. L’atteinte cardiaque est-elle fréquente dans l’amylose familiale ?
4. La transplantation hépatique permet-elle de stopper complètement l’évolution des troubles conductifs dans la muta-
tion méthionine 30 de l’amylose familiale ?
AUTOQUESTIONNAIRE
AUTOQUESTIONNAIRE
FMC
RÉPONSES
RÉPONSES
FMC
1. L’amylose AL.
2. Non, décès par dissociation électromécanique.
3. Oui, elle est quasiment constante sous forme d’une insuffisance cardiaque restrictive avec troubles conductifs.
4. Non, cela justifie de surveiller l’ECG de ces patients et de proposer un stimulateur cardiaque dès qu’apparaît une
anomalie de la conduction.
1
/
5
100%