La resynchronisation ventriculaire dans lPinsuffisance cardiaque

La resynchronisation
ventriculaire
dans l’insuffisance
cardiaque : pourquoi ?
pour qui ?
Delphine Baudouy, Philippe Lanfranchi, Guillaume Théodore,
Jean-Pierre Camous
Service de cardiologie et Laboratoire de thérapeutique, CHU Pasteur, BP 1069,
06002 Nice Cedex
Chez certains insuffisants cardiaques à fonction ventriculaire gauche altérée, il existe une
désynchronisation de la contraction souvent due à des troubles conductifs intraventriculaires.
En stimulant simultanément le septum et la paroi latérale, il est possible de resynchroniser la
contraction et d’augmenter nettement l’efficacité du ventricule gauche. Actuellement, cette
technique est réservée aux sujets ayant une insuffisance cardiaque au stade fonctionnel III et
IV de la NYHA avec une fraction d’éjection ventriculaire gauche inférieure à 35 % et un
élargissement du QRS. Il est probable que les indications vont s’élargir car toutes les études
effectuées sur la resynchronisation montrent une efficacité certaine. Cependant, il reste que
30 % des patients ne sont pas répondeurs. Du point de vue technique, la stimulation ven-
triculaire gauche est généralement obtenue par l’intermédiaire d’une sonde introduite dans
une branche du sinus coronaire.
Mots clés : insuffisance cardiaque, resynchronisation ventriculaire, thérapeutique non
médicamenteuse
Introduction
Dans les pays développés, la fré-
quence de l’insuffisance cardiaque
(IC) est en constante progression en
raison, en particulier, de l’augmenta-
tion de la durée de vie (10 à 20 % des
sujets d’âge compris entre 70 et
80 ans) [1]. Des progrès considérables
ont été effectués dans le domaine de la
prévention et du traitement médical.
Malgré cela, l’IC reste une pathologie
redoutable tant en termes de morbi-
dité que de mortalité [2]. Cette morta-
lité est préférentiellement due à la
progression de l’IC pour les cas les
plus évolués et à la mort subite
(rapportée à un trouble du rythme
ventriculaire) pour les cas les moins
symptomatiques [3].
La transplantation cardiaque reste
la méthode la plus efficace de traite-
ment quand elle peut être mise en
œuvre. Cependant, la rareté des don-
neurs fait qu’elle reste une thérapeu-
tique de diffusion confidentielle.
La correction des valvulopathies,
la résection de certains anévrysmes
et la fermeture de certaines communi-
cations cardiaques sont aussi des
méthodes non médicamenteuses effi-
caces lorsque la cardiopathie n’est pas
trop évoluée.
Plus récemment, il a été montré
que des résultats parfois spectaculai-
res ont pu être obtenus, dans certains
doi: 10.1684/met.2009.0219
m
t
Tirés à part : J.-P. Camous
mt, vol. 15, n° 4, octobre-novembre-décembre 2009
Revue
304
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

cas, par stimulation biventriculaire dite de resynchronisa-
tion ventriculaire (RV) [2, 4-6].
La resychronisation ventriculaire
Pourquoi ?
Chez certains patients insuffisants cardiaques, il existe
une désynchronisation ventriculaire due en particulier à
des troubles conductifs intraventriculaires (présents chez
33 % des patients en IC [7]). Cela se traduit par une dépo-
larisation non synchrone de la masse ventriculaire et
secondairement de la contraction. Certaines zones vont
se contracter alors que d’autres sont déjà en phase de
relaxation, ce qui entraîne une perte évidente d’efficacité.
Cet asynchronisme est d’autant plus délétère que la fonc-
tion ventriculaire gauche est plus altérée.
L’exemple le plus démonstratif est celui des cardio-
myopathies dilatées avec bloc de branche gauche. Chez
ces patients, à la fraction d’éjection abaissée, la dépolari-
sation ventriculaire va débuter au niveau du cœur droit,
se propager vers le septum puis secondairement à la paroi
latérale. La contraction suivant la même séquence.
Un autre exemple, quasi expérimental, est celui de la
stimulation ventriculaire droite où la séquence est sensi-
blement la même avec en plus, selon la place de la sonde,
une dépolarisation qui va débuter à la pointe du ventri-
cule.
Usant les possibilités de la stimulation, en 1994,
Cazeau et al. [8] et Baker et al. [9] décrivent les premiers
cas de stimulation biventriculaire : stimulation simultanée
des ventricules droit et gauche. Si par voie endocavitaire
veineuse, il est relativement facile de mettre une ou deux
électrode(s) de stimulation dans les cavités droites, l’abord
du ventricule gauche est beaucoup moins aisé. La voie
artérielle rétrograde n’est pas possible, en particulier du
fait des risques thromboemboliques et la voie épicardique
transthoracique nécessite une intervention relativement
lourde.
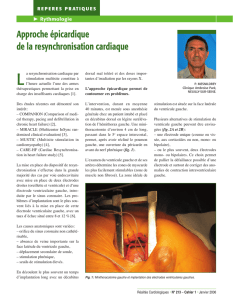
Le réseau veineux coronaire offre la possibilité de sti-
muler le ventricule gauche. Il est actuellement largement
utilisé. En effet, le drainage veineux du ventricule gauche
s’effectue dans l’oreillette droite au niveau de l’ostium
coronaire. Une sonde utilisant initialement la même voie
que la stimulation classique est glissée dans le sinus coro-
naire puis poussée dans une veine latérale du cœur
gauche de manière à ce que l’électrode distale soit
positionnée sur la paroi latérale du ventricule gauche.
Cette intervention est naturellement plus difficile à
mettre en œuvre qu’une stimulation droite exclusive,
fut-elle auriculo-ventriculaire, pour plusieurs raisons.
D’abord, il faut introduire une sonde supplémentaire ce
que ne permet pas toujours le réseau veineux. Ensuite, il
faut cathétériser le sinus coronaire. Enfin, il faut position-
ner le bout distal de la sonde sur la paroi latérale du ven-
tricule gauche. Parfois, le réseau veineux coronaire ne
l’autorise pas. D’autre fois, la sonde entraîne une stimula-
tion du nerf phrénique avec contraction diaphragmatique
insupportable. Enfin, la stabilité de la sonde n’est pas
toujours excellente. Une recherche très active pour
développer des sondes ayant une meilleure stabilité est
actuellement effectuée.
Les risques propres au cathétérisme du sinus coronaire
sont relativement faibles (dissection ou perforation du sinus)
[10] et la plupart du temps sans conséquences graves.
Malgré les difficultés, dans des mains entraînées,
l’intervention est effectuée avec succès dans 90 à 95 %
des cas [10].
Resynchronisation : pour qui ?
Les recommandations actuelles de RV [11, 12] ont été
établies à partir de larges études [13-17] : des sujets en
classe 3 et 4 de la NYHA, malgré un traitement médical
optimal, en rythme sinusal, ayant une dysfonction ventri-
culaire gauche (fraction d’éjection ventriculaire,
FE < 35%) et un QRS élargi (QRS > 120 ms).
Avec ces critères, il a été montré que la RV améliorait
statistiquement la qualité de vie, diminuait la classe fonc-
tionnelle, augmentait la tolérance à l’effort, améliorait les
paramètres de fonction ventriculaire gauche (FE, diamètre
télé diastolique, pressions pulmonaires), diminuait la fré-
quence des hospitalisations et surtout plus récemment la
mortalité globale [18-21].
Cependant, si 70 % des sujets chez qui une RV a été
mise en place sont améliorés (répondeurs), parfois de
manière spectaculaire, un nombre non négligeable
de patients ne tire pas bénéfice de la technique (non
répondeurs) [4].
Il a été recherché des critères supplémentaires pour
sélectionner les patients et en particulier des critères
mécaniques. En effet, ce ne sont pas les troubles électri-
ques que l’on cherche à corriger mais les troubles de la
contractilité qui ne sont pas toujours anatomiquement
superposables. Les études effectuées sur la correction
d’un asynchronisme de contraction (échocardiographie)
n’ont pas, à ce jour, permis de sélectionner les patients
très probablement répondeurs. Il est cependant souhai-
table, au cas où le QRS mesure entre 120 et 140 ms,
d’avoir, en plus du critère électrique de durée du QRS,
un critère mécanique de désynchronisation pour espérer
une amélioration clinique [22]. Une intense recherche
est, là encore, menée dans ce domaine.
La mise en place d’une RV n’a pas de contre-
indication formelle sauf celle qui fait appel au bon sens
(patients en fin de vie)
mt, vol. 15, n° 4, octobre-novembre-décembre 2009 305
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

Il est probable que dans un avenir proche, les indica-
tions vont s’élargir. En effet, l’étude REVERSE [23], récem-
ment présentée, a montré que des résultats encourageants
pouvaient être obtenus chez les sujets en stade 1 et 2 avec
FE < 40 %. La RV, chez des patients asymptomatiques ou
peu symptomatiques, recevant un traitement médical
optimal, améliore le pronostic de la maladie ainsi que la
fonction ventriculaire.
Autres problèmes
et resynchronisation
Troubles du rythme ventriculaire
La mort subite est fréquente chez l’insuffisant car-
diaque. Elle est due, la plupart du temps, à un trouble
du rythme ventriculaire et peut être souvent prévenue
par un défibrillateur automatique implantable (DAI). Or,
les indications actuellement retenues de mise en place
des stimulateurs de resynchronisation recoupent celles
des DAI [24] (prévention de la mort subite chez les sujets
ayant une FE < 35 %). Sachant que tout DAI incorpore un
stimulateur cardiaque, la plupart du temps un DAI triple
chambre de resynchronisation est mis en place chaque
fois qu’il y a une indication de resynchronisation, sauf
chez les patients dont l’espérance de vie est estimée à
moins d’un an (non-indication de DAI). Dans ces cas-là,
un appareil ayant la seule possibilité de stimuler sera
implanté [25].
Certains sujets en IC font moins de troubles du rythme
ventriculaire après RV et amélioration de IC. Il a donc été
recherché si un DAI devait dès lors être systématiquement
implanté. Lin et al. [26] ont montré que la RV ne faisait
pas diminuer statistiquement les troubles du rythme ven-
triculaire. La RV ne permet donc pas de se passer du DAI
[26].
Fibrillation auriculaire
La fibrillation auriculaire est fréquente au cours de
l’insuffisance cardiaque. Dans les publications initiales,
les sous-groupes de patients en fibrillation auriculaire ne
semblaient pas tirer bénéfice de la RV si la conduction
auriculo-ventriculaire n’était pas détruite par radio-
fréquence. Des études plus récentes ont montré qu’il suf-
fisait que la stimulation ventriculaire soit suffisamment
présente (> 80 % des cycles) pour que la RV ait une effi-
cacité comparable à celle rencontrée chez les sujets en
rythme sinusal [27].
Bien qu’en nombre non statistiquement significatif
[28], certains patients en fibrillation auriculaire perma-
nente retournent en rythme sinusal après RV [29]. Cela
pose le problème de la mise en place systématique
d’une sonde auriculaire et tout particulièrement chez les
sujets qui vont être équipés d’un DAI, car si un choc était
délivré pour un trouble du rythme ventriculaire, il pourrait
aussi réduire le trouble du rythme auriculaire.
De plus, les appareils de resynchronisation, stimula-
teurs cardiaques et DAI, ont tous un canal auriculaire
qui peut être simplement occulté. Ces arguments plai-
dent, pour certains, en faveur de la mise en place systé-
matique d’une sonde auriculaire si la fibrillation auricu-
laire n’est pas trop ancienne.
Stimulation VD et insuffisance cardiaque
La stimulation ventriculaire droite crée une désyn-
chronisation expérimentale du ventricule gauche surtout
si l’électrode de stimulation est située à l’apex. La majorité
des patients supporte bien ce type de stimulation. Un cer-
tain nombre d’entre eux va, cependant, évoluer vers
l’insuffisance cardiaque avec apparition des critères
d’indication de resynchronisation. Dans ces cas-là, l’ajout
d’une sonde de stimulation ventriculaire gauche avec
changement d’appareil permet d’obtenir des résultats
comparables à ceux de la resynchronisation effectuée en
première intention [30].
Actuellement, avant la mise en place d’une stimula-
tion ventriculaire droite, une étude de la fonction ventri-
culaire gauche par échocardiographie est systématique. Si
la fonction ventriculaire est altérée, une RV est préconisée
d’emblée même si le sujet est pauci symptomatique.
Syndrome d’apnée du sommeil
Au cours de l’insuffisance cardiaque peut apparaître
un syndrome d’apnée du sommeil d’origine centrale par
hypoperfusion des centres respiratoires. La RV, en amélio-
rant l’hémodynamique cardiaque, peut faire régresser
voire disparaître ces syndromes [31].
Insuffisance mitrale fonctionnelle
En cas de dilatation ventriculaire gauche, l’anneau
mitral augmente de diamètre et entraîne une insuffisance
mitrale fonctionnelle qui contribue à l’aggravation de l’IC.
L’amélioration de la fonction ventriculaire gauche, la
diminution des diamètres ventriculaires contribuent à
diminuer l’importance de cette insuffisance mitrale et à
l’amélioration de IC en particulier à l’effort [32].
Conclusion
Une resynchronisation ventriculaire doit être proposée
chez les patients insuffisants cardiaques à fonction ventri-
culaire gauche très altérée (FE < 35 %) qui restent en
classe 3 et 4 malgré un traitement médical optimal et
dont l’ECG montre un élargissement du QRS. Cette théra-
peutique est efficace chez 70 % des patients (répondeurs).
Elle diminue les symptômes fonctionnels, augmente la
mt, vol. 15, n° 4, octobre-novembre-décembre 2009
Revue
306
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

résistance à l’effort, réduit le nombre des hospitalisations
ainsi que la mortalité.
Il est probable que prochainement les indications vont
s’élargir vers des patients peu ou pas symptomatiques
(classes 1 et 2) afin de prévenir l’augmentation de l’insuf-
fisance cardiaque.
Références
1. Roger VL, Weston SA, Redfield MM, et al. Trends in heart failure
incidence and survival in a community-based population. JAMA
2004 ; 292 : 344-442.
2. Krum H, Abraham WT. Heart failure. Lancet 2009 ; 373 : 941-55.
3. Merit HF investigators. Effect of metropolol CR/XL in chronic
heart failure : Metropolol CR/XL Randomised Intervention trial in
Congestive Heart Failure. Lancet 1999 ; 353 : 2001-7.
4. Albouaini K, Egred M, Rao A, Alahmar A, Wright DJ. Cardiac
resynchronisation therapy : evidence based benefits and patient
selection. Eur J Intern Med 2008 ; 19 : 165-72.
5. Leclercq C, Crocq C, Mabo P, Daubert C. Role of cardiac resyn-
chronisation in the treatment of cardiac failure. Arc Mal Coeur Vais
2004 ; 97 : 1116-21.
6. Daubert JC, Leclercq C, Donal E, Mabo P. Cardiac resynchroni-
sation therapy in heart failure : current status. Heart Fail Rev 2006 ;
11 : 147-54.
7. Mariani JA, Gould PA, Broughton A, Kaye DM. Cardiac resyn-
chronisation therapy for heart failure. Inter Med J 2006 ; 36 :
114-23.
8. Cazeau S, Ritter P, Bakdach S, et al. Four chamber pacing in dila-
ted cardiomyopathy. Pacing Clin Electrophysiol 1994 ; 17 : 1974-9.
9. Bakker P, Meijburg H, De Vries JW, et al. Biventricular pacing in
end-stage heart failure improves functional capacity and left ventri-
cular function. J Interv Cardiol 2000 ; 4 : 395-404.
10. Leclercq C, Daubert JC. Resynchronisation cardiaque. In : Car-
diologie et maladies vasculaires. Soc Fr Cardio. Paris : Masson,
2007 : 723-5.
11. Vardas PE, Auricchio A, Blanc JJ, et al. Guidelines for cardiac
pacing and cardiac resynchronization therapy. Eur Heart J 2007 ;
28 : 2256-95.
12. Hunt SA, Abraham VT, Chin MH, et al. Guideline update for the
diagnosis and management of chronic heart failure in the adult. Cir-
culation 2005 ; 112 : 1825-52.
13. Bristow MR, Saxon LA, Boehmer J, et al. Comparison of medical
therapy, pacing, defibrillation in heart failure (COMPANION) inves-
tigators. Cardiac-resynchronization therapy with or without an
implantable defibrillator in advanced chronic heart failure. N Engl
J Med 2004 ; 350 : 2140-50.
14. Cleland JGF, Daubert JC, Erdmann E, et al. The effect of cardiac
resynchronization therapy on morbidity and mortality in heart fai-
lure (the Cardiac Resynchronization-Heart Failure [CARE-HF]
Trial). N Engl J Med 2005 ; 352 : 1539-49.
15. Cazeau S, Leclercq C, Lavergne T, et al. Effects of multisite
biventricular pacing in patients with heart failure and intraventricu-
lar conduction delay. N Engl J Med 2001 ; 344 : 873-80.
16. Auricchio A, Stellbrink C, Sack S, et al. Pacing therapies in
congestive heart failure (PATH –CHF) study group. Long-term clini-
cal effect of haemodynamically optimized cardiac resynchroniza-
tion therapy in patients with heart failure and ventricular conduc-
tion delay. J Am Coll Cardiol 2002 ; 39 : 2026-33.
17. Young JB, Abraham WT, Smith AL, et al. Combined cardiac
resynchronization and implantable cardioverter defibrillation in
advanced chronic heart failure : the MIRACLE ICD trial. JAMA
2003 ; 289 : 2685-94.
18. Cleland JG, Calvert MJ, Verboven Y, Freemantle N. Effects of
cardiac resynchronization therapy on long-term quality of life : an
analysis from the cardiac resynchronisation-heart failure (CARE-HF)
study. Am Heart J 2009 ; 157 : 457-66.
19. Jaswal A, Singh J, Dar MA, Kler TS. What is cardiac resynchoni-
sation therapy and who will benefit ? J Assoc Physicians India 2007 ;
55 (suppl) : 62-5.
20. Cazeau S, Alonso C, Jauvert G, et al. Cardiac resynchronization
therapy. Europace 2004 ; 5 (suppl 1) : S42-8.
21. Freemantle N, Tharmanathan P, Calvert MJ, et al. Cardiac resyn-
chronisation for patients with heart failure due to left ventricular sys-
tolic dysfunction –a systematic review and meta-analysis. Eur
J Heart Fail 2006 ; 8 : 433-40.
22. Nice technology appraisal guidance 12O. Cardiac resynchroni-
sation therapy for the treatment of heart failure. National institute for
health and clinical excellence. London. 2007 ; p 1-18.
23. Daubert JC. Cardiac resynchronization therapy prevents disease
progression in NYHA Class I-II heart failure patients : 24-month
results from the European cohort of the REVERSE trial. Am J Coll of
Cardiol. 58 th Annual Scientific Session ; march 29-31, 2009.
24. Epstein AE, DiMarco JP, Ellenbogen KA, et al. Guidelines for
Device-Based Therapy of Cardiac Rhythm Abnormalities : A Report
of the American College of Cardiology/American Heart Association
Task Force on Practice Guidelines. Circulation 2008 ; 117 : e
350-408.
25. Jego C, Deharo JC. Implantable defibrillator and ventricular
resynchronisation. Arch Mal Coeur Vaiss 2004 ; 97 : 1122-9.
26. Lin G, Rea RF, Hammill SC, et al. Effect of cardiac resynchroni-
sation therapy on occurrence of ventricular arrhythmia in patients
with implantable cardioverter defibrillators undergoing upgrade to
cardiac resynchronisation therapy devices. Heart 2008 ; 94 :
186-90.
27. Khadjooi K, Foley PW, Chalil S, et al. Long-term effects of car-
diac resynchronisation therapy in patients with atrial fibrillation.
Heart 2008 ; 94 : 879-83.
28. Hoppe UC, Casares JM, Eiskjaer H, et al. Effect of cardiac resyn-
chronization on the incidence of atrial fibrillation in patients with
severe heart failure. Circulation 2006 ; 114 : 18-25.
29. Hauck M, Bauer A, Voss F, Katus HA, Becker R. Effect of car-
diac resynchronization therapy on conversion of persistent atrial
fibrillation to sinus rhythm. Clin Res Cardiol 2009 ; 98 : 189-94.
30. Foley PNX, Muhyaldeen SA, Chalil S, et al. Long-term effects of
upgrading from right ventricular pacing to cardiac resynchroniza-
tion therapy in patients with heart failure. Europace 2009 ; 11 :
495-501.
31. Oldenburg O, Faber L, Vogt J, et al. Influence of cardiac resyn-
chronisation therapy on different types of sleep disordered brea-
thing. Eur J Heart Fail 2007 ; 9 : 820-6.
32. Ennezat PV, Gal B, Kouakam C, et al. Cardiac resynchronisation
therapy reduces functional mitral regurgitation during dynamic
exercise in patients with chronic heart failure : an acute echocardio-
graphic study. Heart 2006 ; 92 : 1091-5.
mt, vol. 15, n° 4, octobre-novembre-décembre 2009 307
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.
1
/
4
100%