Lire l`article complet

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XV - n° 7 - septembre 2011
241
Mise au point
L’hormone anti-Müllérienne
The anti-Müllerian hormone
Nathalie di Clemente*
RÉSUMÉ
Summary
»
L’hormone anti-Müllérienne (AMH) a pour rôle principal de
provoquer, chez le fœtus mâle, la régression de leurs canaux de
Müller, qui se différencient chez la femelle en trompes, utérus et
partie supérieure du vagin. Chez la femelle, l’AMH n’est sécrétée
qu’après la naissance et elle inhibe le recrutement et la maturation
folliculaire. Son dosage est un marqueur très fiable de la réserve
ovarienne et il est de plus en plus utilisé en assistance médicale
à la procréation.
Mots-clés : Hormone anti-Müllérienne – Mâle – Femelle – Régulation
– Signalisation.
The main role of anti-Müllerian hormone (AMH) is to
induce in male fetuses, the regression of Müllerian ducts,
which are the primordium of uterus and tubes in females. In
females, AMH is secreted after birth and it inhibits follicular
recruitment and maturation. Serum AMH is a reliable marker
of follicular reserve and is now a useful tool in the field of
human reproductive endocrinology.
Keywords: Anti-Müllerian hormone – Male – Female –
Regulation – Signaling.
*Inserm, U782, Clamart ;
université Paris-Sud,
UMR-S0782, Clamart ;
AP-HP, hôpital Antoine-
Béclère, Clamart.
Historique
L’existence de l’hormone anti-Müllérienne (AMH) a été
postulée en 1953 par le Pr Alfred Jost pour expliquer la
régression, chez les fœtus mâles, des canaux de Müller,
qui représentent les ébauches des trompes, de l’utérus
et de la partie supérieure du vagin (1). La protéine a
été purifiée en 1984 par l’équipe de N. Josso ; en 1986,
son gène a été cloné, par cette même équipe d’une
part et par une équipe américaine d’autre part. L’AMH
est une glycoprotéine de 140 kDa appartenant à la
famille du Transforming Growth Factor beta (TGFβ), qui
comprend notamment les inhibines, les activines et les
Bone Morphogenetic Proteins (BMPs).
Expression et régulation
Chez le mâle
Chez le mâle, l’AMH est exprimée par les cellules de
Sertoli, depuis leur différenciation et jusqu’à la puberté
(figure 1, p. 242) [1]. L’expression de l’AMH testiculaire
est régulée principalement par des facteurs ou cofac-
teurs de transcription (2). SOX9 initie l’expression de
l’AMH au moment de la différenciation gonadique. SF1,
GATA 1,4 et 6 ainsi que WT1 stimulent son expression,
alors que DAX1 et FOG 1 et 2 la répriment. Après la
naissance, la FSH stimule la production d’AMH jusqu’à
la puberté, où la testostérone et le TNFα produit par
les cellules germinales entrant en méïose l’inhibent.
Chez la femelle
Chez la femelle, l’AMH est exprimée par les cellules de
la granulosa, depuis le début de la folliculogenèse et
jusqu’à la ménopause (figure 1, p. 242) [3]. La synthèse
d’AMH débute au stade follicule primaire et devient
maximale dans les follicules préantraux et les petits
follicules antraux. Aux autres stades antraux, l’expression
de l’AMH se limite aux cellules du cumulus et à celles
situées en bordure de la cavité antrale. La régulation
de l’AMH ovarienne demeure peu connue (4). Quelques
études isolées ont montré une stimulation de la syn-
thèse d’AMH par des cellules de la granulosa, coculti-
vées en présence d’ovocytes de follicules préantraux
et préovulatoires, ou cultivées en présence de BMPs,
et une inhibition de l’expression de l’AMH par la tes-
tostérone. L’effet des gonadotropines et de l’estradiol
est plus controversé.
Mode d’action
Comme les autres membres de la famille du TGFβ, l’AMH
doit être clivée pour être active (figure 2, p. 242). Elle

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XV - n° 7 - septembre 2011
242
Mise au point
médie ensuite ses effets via 2 types de récepteurs sérine/
thréonine kinase : un récepteur de type II qui lui est spé-
cifique (AMHR-II) sur lequel se fixe la partie C-terminale
de l’AMH, et des récepteurs de type I, ALK2, ALK3 et
ALK6 qu’elle partage avec les BMPs (5). En présence
d’AMH, ces récepteurs phosphorylent des protéines
cytoplasmiques appelées Smad1, Smad5 ou Smad8,
que l’AMH partage avec les BMPs. Ces protéines sont
alors capables d’interagir avec une Smad commune
à tous les membres de la famille du TGFβ : Smad4 ; le
complexe ainsi formé est transloqué vers le noyau pour
activer les gènes cibles de l’AMH.
L’AMHR-II est exprimé chez le mâle par les cellules
mésenchymateuses entourant le canal de Müller au
moment de leur période de régression, les cellules de
Sertoli et les cellules de Leydig (1). Chez la femelle,
l’AMHRII est détecté dans les cellules de la granulosa
des follicules en croissance, les cellules thécales, mais
aussi dans l’endomètre et le sein, suggérant une action
autocrine, paracrine, voire endocrine de l’AMH.
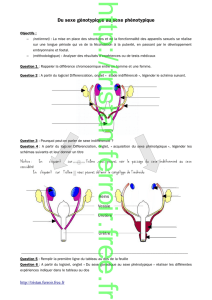
Rôle physiologique
Chez le mâle
L’AMH est connue pour son rôle dans la différenciation
sexuelle des fœtus mâles, chez lesquels elle provoque
la régression des canaux de Müller, qui représentent
l’ébauche des trompes, de l’utérus et de la partie pos-
térieure du vagin chez les femelles (figure 3, p. 243) [1].
Le phénotype des hommes atteints du syndrome de
persistance des canaux de Müller, qui ont des mutations
de l’AMH ou de l’AMHR-II, et celui des souris invalidées
pour ces 2 gènes, confirment ce rôle physiologique
majeur de l’AMH.
Les souris qui surexpriment l’AMH – situation qui n’est
pas rencontrée naturellement – nous renseignent sur
un éventuel rôle de l’AMH chez le mâle jusqu’à la
puberté : ces souris présentent des taux de testosté-
rone réduits, suggérant un effet de l’AMH sur les cellules
de Leydig (6).
Chez la femelle
Les modèles de souris invalidées pour l’AMH et son
récepteur ont permis de mettre un évidence un rôle
de l’AMH chez la femelle (3). Ces souris présentent un
plus grand nombre de follicules en croissance à 2 mois,
mais une diminution précoce de leur réserve folliculaire
à 8 mois, indiquant un contrôle négatif de l’AMH sur la
folliculogenèse (figure 3, p. 243).
Ce résultat est venu conforter les données antérieures
obtenues sur des cellules de la granulosa en culture,
montrant un effet répresseur de l’AMH sur plusieurs
marqueurs de la folliculogenèse, comme la synthèse
de progestérone, l’activité aromatase ou le nombre de
récepteurs à la LH.
Récemment, des corrélations entre des polymorphismes
de l’AMH ou de son récepteur d’une part, et le taux
'JHVSF Mode d’action de l’AMH. L’AMH est clivée en 2 fragments N- et C-terminaux. Après fixation
du fragment C-terminal sur le récepteur spécifique de l’AMH (AMHR-II), il y a interaction avec un
récepteur de type I (ALK2, 3 ou 6), phosphorylation d’une protéine Smad (Smad1, 5 ou 8), interaction
avec Smad4 et translocation dans le noyau du complexe où il peut activer les gènes cibles de l’AMH.
Cofacteur
Coactivateur
ou corépresseur
Gène cible
P
P
AMHR-II ALK2
ALK3
ALK6
Smad1, 5, 8
P
P
AMH N C
Smad4
'JHVSF Expression des ARN messagers (ARNm) de l’AMH dans des gonades de souris. Les ARNm
de l’AMH (en rouge) sont détectés dans le testicule mâle au niveau des cellules de Sertoli des
cordons séminifères (ici, un fœtus mâle de 14,5 jours postconception). Chez la femelle adulte,
les ARNm de l’AMH sont exprimés par les cellules de la granulosa des follicules en croissance.
Fœtus mâle 14,5 jours postconception Femelle adulte

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XV - n° 7 - septembre 2011
243
L’hormone anti-Müllérienne
d’estradiol en phase folliculaire et l’âge de la méno-
pause d’autre part, ont confirmé le contrôle inhibiteur
de l’AMH sur la folliculogenèse (7).
Implication en pathologie
Le syndrome de persistance
des canaux de Müller
Le syndrome de persistance des canaux de Müller
(PMDS) est la seule pathologie liée à l’AMH (1). Il s’agit
d’un cas de pseudo-hermaphrodisme masculin, qui se
manisfeste souvent par une cryptorchidie (en raison de
la persistance de résidus utérins), chez des hommes par
ailleurs normalement virilisés. Le PMDS est dû à des
mutations de l’AMH ou de son récepteur, l’étiologie du
syndrome restant inconnue dans 15 à 20 % des cas. Le
dosage de l’AMH sérique avant la puberté permet de
distinguer ces 2 causes.
L’hormone anti-Müllérienne
comme marqueur de certaines pathologies
Chez l’homme
L’AMH est un marqueur de la présence de tissu testiculaire
dans certains cas d’ambiguité sexuelle (8). L’AMH sérique
permet notamment, chez les patients 46,XY, d’orienter le
diagnostic vers une dysgénésie gonadique ou une défi-
cience dans la production ou l’action des androgènes. Ce
marqueur a l’avantage d’éviter une stimulation par l’hCG
avant un dosage de la testo stérone chez l’enfant.
L’AMH sérique reste élevée après la puberté chez les
hommes souffrant d’hypogonadisme hypogonadotrope et
elle constitue un bon marqueur de l’efficacité du traitement
par la testostérone ou par les gonadotrophines.
Enfin, l’AMH dans le liquide spermatique est un marqueur
de la présence de spermatozoïdes testiculaires chez les
hommes présentant une azoospermie non obstructive.
Chez la femme
L’AMH sérique est un marqueur très précoce des can-
cers des cellules de la granulosa et de leur récidive (2).
L’AMH sérique est également élevée chez les femmes
ayant un syndrome des ovaires polykystiques, l’une des
principales cause d’infertilité féminine (7) ; cela est dû à
une augmentation du nombre de petits follicules et de
la sécrétion d’AMH par les cellules de la granulosa. En
revanche, on ignore toujours si cette production accrue
d’AMH est responsable de l’inhibition de la croissance
folliculaire observée chez les femmes atteintes de ce
syndrome.
Marqueur de la fonction ovarienne
Au début des années 2000, plusieurs équipes de clini-
ciens ont montré que l’AMH sérique reflétait très bien
le nombre de petits follicules présents dans les ovaires
d’une femme, et constituait donc un très bon marqueur
de sa réserve ovarienne (7). L’AMH sérique a l’avantage
de ne pas varier au cours du cycle et de rester stable
à plusieurs mois d’intervalle. L’AMH sérique diminue
avec l’âge et avec les traitements gonadotoxiques. Par
conséquent, elle est devenue un marqueur de la fonc-
tion ovarienne très utile en assistance médicale à la
procréation, pour prévoir l’efficacité d’une stimulation
ovarienne et adapter le traitement.
■
'JHVSF Rôles physiologiques de l’AMH.
Chez le fœtus mâle, lors de la différenciation sexuelle, l’AMH sécrétée par les cellules de Sertoli
induit la régression des canaux de Müller qui représentent les ébauches de trompes, de l’utérus
et de la partie postérieure du vagin chez les femelles. Chez les femelles, l’AMH est produite par
les cellules de la granulosa et elle inhibe la folliculogenèse.
AMH
testiculaire
GONADES
AMH
ovarienne
UTÉRUS
Cellules
de la granulosa
Cellules
de Sertoli
Mâle Femelle
Josso N, Picard JY, Rey R, di Clemente N. Testicular anti-
Müllerian hormone: history, genetics, regulation and clinical
applications. Pediatr Endocrinol Rev 2006;3:347-58.
Rey R, Lukas-Croisier C, Lasala C, Bedecarras P. AMH/MIS:
what we know already about the gene, the protein and its
regulation. Mol Cell Endocrinol 2003;211:21-31.
Visser JA, de Jong FH, Laven JSE, Themmen APN. Anti-Müllerian hor-
mone: a new marker for ovarian function. Reproduction 2006;131:1-9.
Taieb J, Grynberg M, Pierre A et al. FSH and its second
messenger cAMP stimulate the transcription of human anti-
Müllerian hormone in cultured granulosa cells. Mol Endocrinol
2011;25:645-55.
di Clemente N, Josso N, Gouédard L, Belville C. Components
of the anti-Müllerian hormone signaling pathway in gonads.
Mol Cell Endocrinol 2003;211:9-14.
Josso N, Racine C, di Clemente N, Rey R, Xavier F. The role
of anti-Müllerian hormone in gonadal development. Mol Cell
Endocrinol 1998;145:3-7.
La Marca A, Sighinolfi G, Radi D et al. Anti-Müllerian hor-
mone (AMH) as a predictive marker in assisted reproductive
technology (ART). Hum Reprod Update 2010;16:113-30.
Grinspon RP, Rey RA. Anti-Müllerian hormone and Sertoli
cell function in paediatric male hypogonadism. Horm Res
Paediatr 2010;73:81-92.
Références
1
/
3
100%