URL source du document

URL source du document
http://www.guimberteau.fr.st/
Document
Contrôle des transformations chimiques
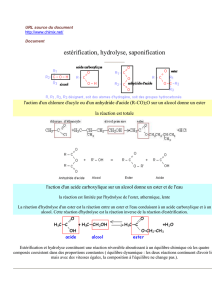
1. Changement de réactif pour la formation d’un ester
Les réactions d’estérification et hydrolyse sont lentes, inverses l’une de l’autre et donc limitées.
Pour rendre impossible la réaction inverse et avoir une transformation totale, on change le
réactif.
La réaction d'un anhydride d'acide avec un alcool est représentée par l'équation suivante :
La réaction est quasi-totale et plus rapide que l'estérification à partir d'un acide et d'un alcool.
Application à la synthèse de l'aspirine.
2. Changement de réactif pour l’hydrolyse d’un ester
1. Réaction d’un ester avec les ions OH–
Un ester réagit avec un ion hydroxyde pour donner un ion carboxylate et un alcool : c’est une
réaction d’hydrolyse basique appelée réaction de saponification.
La réaction est :
rapide à température modérée et très rapide à chaud,
totale : on atteint l’avancement maximal.
Équation de la réaction :

2. La saponification des corps gras
Corps gras : triglycérides ou triesters du glycérol et d’acides gras dont le squelette comporte
entre 12 et 22 atomes de carbone :
Fabrication d’un savon
A chaud, on fait réagir de la soude concentrée sur un corps gras (huile, graisse,…) => c’est la
saponification.
Ensuite, on verse le tout sur une solution d’eau salée, le savon précipite (devient solide et tombe
au fond) => c’est le relargage.
On ajoute ensuite différents parfums au savon, et on le moule.
Propriétés des savons
o Le savon est soluble dans l’eau, insoluble dans l’eau salée : la solution aqueuse est
basique (9 = pH = 10).
o L’anion carboxylate R–COO– : symbolisé par
On les appelle molécule tensio-actif.


3. Transformations mettant en jeu plusieurs réactions
Prenons le cas de l'aspirine, elle possède un groupe acide carboxylique et un groupe ester. Le
groupe acide carboxylique réagit avec la souden selon une réaction acido-basique, totale et très
rapile même à froid. Le groupe ester réagit avec la soude selon une réaction de saponification,
totale et relativement rapide, mais nécessitant une élévation de température et l'emploi d'une
solution de soude concentrée.
En travaillant à température ambiante et avec des solutions diluée de souden on n'observera
quasiment que la réaction acido-basique. En revanche, à température élevée et avec une solution
concentrée de soude, on observera les deux réactions.
4. Catalyse Action d'un catalyseur

1. Définition d’un catalyseur
Un catalyseur est une espèce chimique capable d’augmenter la vitesse d’une réaction
thermodynamiquement possible.
o Si plusieurs réactions sont possibles, il augmente la vitesse de réaction de manière
sélective.
o Il n’intervient pas dans le bilan réactionnel : il agit comme un intermédiaire et est
toujours utilisé en faible quantité.
2. Catalyse homogène
Le catalyseur, les réactifs et les produits constituent un système monophasé.
Le catalyseur est consommé dans une première étape, restitué lors d’une étape ultérieure.
Exemple : l’acide sulfurique (liquide) dans l’estérification et l’hydrolyse.
3. Catalyse hétérogène
Le catalyseur, les réactifs et les produits sont présents au moins sous deux phases distinctes.
Ces catalyseurs sont des solides organiques de toute nature, généralement très sélectifs.
Les molécules du réactif s’absorbent (= se fixent en surface) à la surface du catalyseur et sont
dissociées en atomes instables « prêts à réagir ».
La surface du catalyseur joue donc un rôle important.
Exemple : platine (solide) et gaz d’échappement dans les pots catalytiques.
4. Catalyse enzymatique
Un enzyme est une protéine qui accélère une réaction biochimique spécifique et qui se retrouve
inchangée en fin de réaction.
C’est un catalyseur extrêmement sélectif, qui peut « reconnaître » la géométrie de la molécule.
Exemple : l’amylase, enzyme de la salive, catalyse l’hydrolyse de l’amidon.
1
/
5
100%