Sujet d`ordre général

hn
2014-12-29
L’électron autour du noyau
Pour compléter l’étude de l’électron, il est tout
naturel de connaître les propriétés de l’assemblage
des électrons dans un atome, autour d’un noyau.
Comment peut-on étudier cet assemblage ?
Quelles sont les lois qui régissent cet assemblage ?
Comment la mécanique classique peut aider à la
compréhension de ce système « solaire » ?
Qu’est-ce que la mécanique ondulatoire vient apporter
à la connaissance de cet assemblage ?

hn
2014-12-29
Introduction
RUTHERFORD a montré qu’un atome possède un
noyau central très petit et des électrons tournant sur
des orbites.
BOHR a proposé une explication détaillée des
spectres atomiques et, en particulier, du spectre de
l’hydrogène.
Mais nous verrons que la mécanique classique est
impuissante à décrire les phénomènes.
Seule l’assimilation de l’électron à une onde conduit
à une théorie cohérente.

hn
2014-12-29
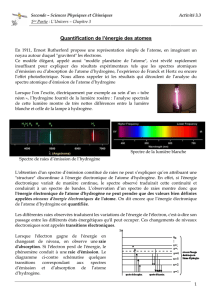
Le spectre de l’hydrogène
Si on provoque une décharge électrique dans une
atmosphère raréfiée d’hydrogène, on observe
l’émission d’une lumière pourpre.
Cette lumière analysée au spectrographe peut être
séparée en un certain nombre de fréquences.
Ce spectre de raies est caractéristique de l’élément.
Ces mêmes raies ou fréquences apparaissent
également en absorption (raies noires sur fond
continu) dans le spectre du soleil par exemple.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
1
/
52
100%