Représentation de Lewis

Chap C8 (livre p146)
Structure
des molécules
I- De l’atome à la molécule, géométrie des molécules :

Rappel :
Les atomes tendent à adopter la structure électronique
stable des gaz nobles, c’est-à-dire à posséder 2 électrons
(règle du duet) ou 8 électrons (règle de l’octet) sur leur couche
externe.
La couche K a 2 électrons au maximum, la couche L 8 et la
couche M 18.
10Ar : (K)2(L)8
18Ne : (K)2(L)8(M)8
2He : (K)2
Activité documentaire et expérimentale N°1 à coller

a) Formule brute de l’arginine : C6H14N4O2
b) La représentation de Lewis indique les liaisons covalentes
(doublets liants), mais aussi les doublets non-liants, ce que la
formule développée n’indique pas.
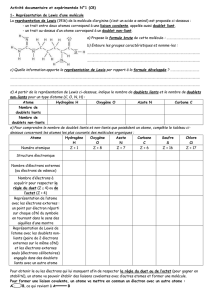
Atome H O N C
Nombre de doublets
liants 1 2 3 4
Nombre de doublets
non-liants 0 2 1 0
c)

Atome Hydrogène
H
Oxygène
O
Azote
N
Carbone
C
Soufre
S
Chlore
Cl
Numéro atomique Z = 1 Z = 6 Z = 8 Z = 17 Z = 16 Z = 17
Structure électronique (K)1(K)2(L)6(K)2(L)5(K)2(L)6(K)2(L)8(M)6K)2(L)8M(7)
Nombre d’électrons
externes
1 6 5 4 6 7
Nombre d’électrons à
acquérir pour respecter
la règle du duet
ou la règle de l’octet
1 2 3 4 2 1
Représentation des atomes
avec leurs électrons
externes H O N C S Cl
Représentation de Lewis
des atomes H O N C S Cl
d)
. .
. .
.
. .
.. .
.
.. .
..
....
. . .
....
..
.... . . .
.. .
.
..

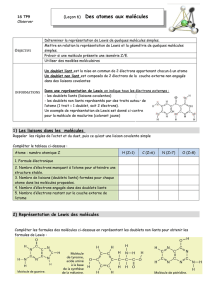
Atome Symbole Représentation
atomique
C
O
HHydrogène
Carbone
Oxygène
Azote N
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
1
/
15
100%