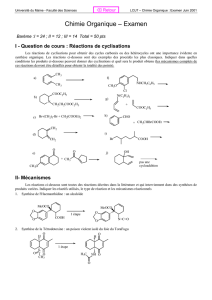
Document

CHAPITRE CHIMIE ORGANIQUE
Bernaud J 1/7
Bases sur nomenclature en chimie organique
1°) Définitions
En chimie organique, les composés sont forcément carbonés, les éléments rencontrés les plus
fréquemment sont C, H, O, N ….
On rappelle que le carbone est tétravalent, l’hydrogène monovalent, l’oxygène bivalent et l’azote
trivalent ; ils peuvent donc s’engager respectivement dans quatre, une, deux et trois liaisons de covalence.
Pour nommer ces différents composés, on tient compte du nombre d’atomes de C dont ils sont constitués,
ainsi qu’un certains nombre de règle : ceci correspond à la nomenclature édictée par l’UICPA.
http://perso.wanadoo.fr/guy.chaumeton/tsnomenc.htm
http://membres.lycos.fr/jjww/
La plus importante :
La chaîne d’atomes de C (carbone) la plus longue est appelée chaîne principale, son nombre d’atomes
donne le nom à la molécule.
On numérote la chaîne principale, de manière à ce que le numéro du 1er atome de C portant une
ramification soit le plus petit possible.
Les différents grands types de réaction sont :
Réaction de substitution : remplacement d’un atome par un autre
Réaction par élimination : une molécule perd certains de ces atomes ⇒ création de liaisons
multiples
Réaction de réarrangement : changement de place d’atomes
Réaction d’addition : une molécule se scinde en deux fragments
2°) Composés carbonés saturés et insaturés
saturé : tous les atomes de C sont reliés par des liaisons simples
insaturé : liaisons double ou triple
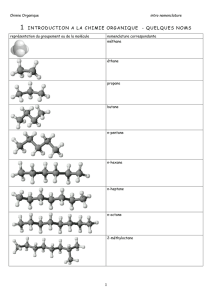
2.1) Les alcanes
Composés carbonés saturés, le nom sera suivi par le suffixe en « ane »
Nombre d’atome de C Préfixe Nom de la molécule Formule brute
1 méth méthane
2 éth éthane
3 prop propane
4 but butane
5 pent pentane
6 hex hexane
7 hep heptane
8 oct octane
9 non nonane
10 déc décane

CHAPITRE CHIMIE ORGANIQUE
Bernaud J 2/7
Les alcanes liquides ne dissolvent pas les composés ioniques, mais les corps moléculaires, les corps gras.
Ils sont utilisés dans de nombreux détachants, étant constitués exclusivement d’atomes de C et H, ils sont
très inflammables et toxiques.
Certains ramifications portent un nom
Radical :
méthyl
éthyl
méthylène
éthylène
2.2) Les cyclanes
Leur chaîne carbonée principale est refermée sur elle-même et forme un cycle.
Nom de l’alcane correspondant précédé de cyclo :
Exemple : cyclohexane
2.3) Les alcènes
Ils possèdent une double liaison C, C. leur suffixe est en « ène »
Ecrire la formule développée du but-1-ène, du 3 méthyl-but- 2 ène.
Radical : vinyl
2.4) Les alcynes
Ils possèdent une triple liaison C, C. leur suffixe est en « yne »
Ecrire la formule semi-développée de l’éthyne, du 2 méthyl, hex-3-yne
CH3
CH3CH2
CH2
CH2 CH2
CH2
CH2
CH2
CH2
CH2
CH2
C
CH3
C
H
CH3
CH3
C
H
H
C
H
C
H
H
H
H
H
C
C
H
C
H
H
CH
HC C
H
H
C
C
C
H
H
H
H
C
CH3
CH3

CHAPITRE CHIMIE ORGANIQUE
Bernaud J 3/7
3°) Les composés carbonés aromatiques
aromatique : le cycle est plan et chaque atome de C met en commun un électron célibataire pour
former un nuage d’électrons délocalisé sur l’ensemble du cycle.
Exemple : Benzène
Toluène : 2 méthyl, benzène
Styrène : 2 vinyl, benzène
Radical : phényl
C
C
C C
C
C
CH3
H H
H
H
H
C
C
C C
C
C
H
H H
H
H
H
C
C
C C
C
C
HH
H
H
H
CH C
H
H

CHAPITRE CHIMIE ORGANIQUE
Bernaud J 4/7
4°) Composés organiques oxygénés
4.1) Fonction ou groupement alcool
suffixe en « ol »
formule générale : R C OH
radical : hydroxyle - OH
Exemples
Propane –1,2,3-triol (glycérol)
Ethane-1,2-diol (ethylene glycol)
Méthanol ou alcool méthylique
Menthol (2 isopropyl-5méthyl-cyclohexan-1ol)
4.2) Groupement éther-oxyde
oxyde suivi du nom, formule générale symétrique R – O – R ; formule mixte R’ - O - R
Exemple : méthoxy-méthane ou oxyde de méthyle et d’éthyle
CH3- O - CH2 - CH3
4.3) Fonction aldéhyde
suffixe en “al”, formule générale R
Exemple : éthanal
CH2OHCH2OH
CH2OHCHOHCH2OH
CH3OH
CH
CH
CH2
CH2
CH
CH2
OH
CH3
CH
CH3
CH3
C
O
H
C
H
H
H
C
O
H

CHAPITRE CHIMIE ORGANIQUE
Bernaud J 5/7
4.4) Fonction cétone
suffixe en « one » formule générale symétrique R – C – R ; formule mixte R’ - C - R
Exemples : pentan-2one
Propanone (acétone ou di-méthyl cétone)
4.5) Groupement acide carboxylique
Il contient le terme « acide » et le suffixe en « oïque »
Formule générale : R –COOH
Exemples (nom usuel) :
Acide méthanoïque (acide formique) :
HC
O
OH
CH C
O
OH
3
Acide éthanoïque (acide acétique) :
Acide propènoïque (acide acrylique) :
CH C
O
OH
2
CH
Acide benzène –1,2-dicarboxylique (acide orthophtalique) :
Acide benzène –1,4-dicarboxylique (acide tere ou paraphtalique)
4.6) Groupement ester
suffixe en « ate »
Formule générale :
CH3 CCH2CH2CH3
O
O O
C
H
H
H
CCH
H
H
O
R C O R'
O
 6
6
 7
7
1
/
7
100%