Télécharger ce fichier PDF - Journal Africain d`Imagerie Médicale

Apport de l’IRM dans le diagnostic de la non compaction du ventricule gauche : à propos
de deux cas.
(MRI in the diagnosis of left ventricular non-compaction: two cases report.)
Diop A D (1), Cassagne L (2), ALFIDJA A (2), GageanuC (2), DiopA N (1),
Chabrot P (2), Boyer L (2).
(1) Service de radiologie CHU de Fann : Avenue Cheikh Anta DIOP BP 5035 Dakar,Sénégal
(2) Service de Radiologie B, CHU Gabriel MONTPIED : 58 Rue Montalembert,63003, Clermont-Ferrand, France.
RESUME
La non compaction du ventricule gauche (NCVG) est une cardiomyopathie génétique sous diagnostiquée car très
peu connue. Nous rapportons deux cas de NCVG diagnostiqués à l’IRM chez des patients de 40 ans et 61 ans
adressés pour altération de la fonction cardiaque à l’échocardiographie.
L’IRM objectivait chez les deux patients un aspect de double couche myocardique, une interne non compactée
présentant de nombreuses trabéculations et une externe compactée, mince avec un rapport myocarde non compacté
sur myocarde compacté en diastole supérieur à 2,3 compatible avec une NCVG.
Mots clés : Non compaction du ventricule gauche ; Cardiomyopathie génétique ; IRM.
ABSTRACT:
The non-compaction of the left ventricle (NCVG) is an underdiagnosed and rare genetic cardiomyopathy. We
report two cases of NCVG diagnosed on MRI in patients 40 years and 61 years referred for alteration of cardiac
function on echocardiography.MRIshowedin both patientsadouble aspectof myocardiallayer, an internal
uncompressedwithmanytrabeculaeand an externalcompacted,thin with a myocardium comparedtonon-compacted
and compactedgreater than 2,3 atdiastole compatible with NCVG.
Key words: Left ventricular non-compaction; Genetic cardiomyopathy; MRI
Adresse hôpital d’étude : Service de Radiologie B, CHU Gabriel MONTPIED, 58 Rue Montalembert, 63003, Clermont-
Ferrand, France.
Correspondance et tiré à part
Dr Abdoulaye Dione DIOP, service de radiologie CHU de Fann : Avenue Cheikh Anta DIOP BP 5035
Dakar, Sénégal
Tel : 0022177608882/00221708776151
Mail : adionediop@yahoo.fr
FAIT CLINIQUE
J Afr Imag Méd 2014; 6 (3):50-55

INTRODUCTION
La non compaction du ventricule gauche
(NCVG) est une variété relativement rare de
cardiomyopathie, encore assez peu reconnue [1].
Il s'agit d'une cardiopathie congénitale liée à un
arrêt de développement prématuré du myocarde,
conduisant à un aspect de double couche
myocardique : une externe compacte mince et
une interne non compactée, constituée de
formations cryptiques avec hypertrabéculations.
Nous rapportons deux observations de NCVG
diagnostiquées à l’IRM chez des adultes.
OBSERVATION 1
Il s’agissait d’un patient de 61 ans sans facteur
de risque cardiovasculaire, suivi depuis 2004
pour une cardiomyopathie hypertrophique
découverte devant des troubles de la
dépolarisation à l’électrocardiogramme. Il a
bénéficié d’une échocardiographie dans le cadre
d’un bilan de suivi de sa cardiomyopathie qui
montrait un ventricule gauche non dilaté mais
hypokinétique de manière globale avec une
fraction d’éjection du ventricule gauche estimée
à 50%.
Devant ce tableau une IRM cardiaque a été
demandée en complément pour une meilleure
évaluation de la fonction ventriculaire gauche.
L’IRM a été réalisée avec une machine siemens
avanto 1.5 Tesla selon le protocole suivant :
Acquisition axiale SE T1 (black blood)
sur l'ensemble du médiastin, EG T1 et
Ciné 3D en coupes de 7 mm jointives sur
les plans du long axe du VG, des 4
cavités et du petit axe du VG.
Etude de la perfusion de premier passage
après 1ere dose de Dotarem et du
rehaussement tardif à 10 minutes après
injection d’une deuxième dose de
Dotarem à raison de 0.2ml/Kg de poids
corporel.
Elle retrouvait une fonction ventriculaire gauche
relativement conservée avec une fraction
d'éjection mesurée à 55 %. Les volumes indexés
télésystolique et télédiastolique étaient
respectivement à 64 ml/m2 en et 23 ml/m2. Il
n’y avait pas de trouble de la cinétique
segmentaire.
En revanche, l’analyse morphologique retrouve
un aspect trabéculé du myocarde sous
endocardique, avec un aspect de double
couche (fig. 1):
une couche externe compactée de 5 mm
d’épaisseur et
une couche interne non compactée de 12
mm d’épaisseur.
Cet aspect répondait aux critères diagnostics de
non compaction ventriculaire avec un ratio
myocarde non compacté sur myocarde compacté
de 2.4 endiastole.
L’étude du rehaussement tardif ne retrouvait pas
de prise de contraste tardive notamment en sous
endocardique. Il n’y avait pas de thrombus intra
cavitaire.
OBSERVATION 2
Il s’agit d’une patiente de 40 ans sans
antécédents particuliers, suivie depuis l'enfance
pour des troubles du rythme ventriculaire en
rapport avec une cardiomyopathie étiquetée
hypertrophique avec hypertrophie septo-apicale,
traitée par bêtabloquants jusqu'à l'âge de 32 ans.
Son dernier bilan était favorable avec seulement
des extra systoles supra ventriculaires et
ventriculaires au Holter. Elle était quasiment
asymptomatique avec quelques perceptions
extrasystoliques. L'examen physique était normal
avec une tension artérielle à 108/65 mm Hg.
L'ECG retrouvait un rythme sinusal à 76
battements/mn avec des troubles de la
repolarisation dans le territoire inférieur et latéral
avec axe QRS à -60.
L'échocardiographie Doppler objectivait un
aspect d'épaississement apico-septal avec au
niveau de la pointe un aspect de myocarde non
compacté. La fraction d'éjection globale du VG
A Dione DIOP et al
J Afr Imag Méd 2014; 6 (3):50-55

était peu diminuée à 50% avec fraction de
raccourcissement à 25%.
L'IRM cardiaque réalisée en complément
retrouvait une fraction d'éjection du ventricule
gauche à 55% avec des volumes télédiastolique
et télésystolique indexés à 64 ml/m² et 30 ml/m².
Par contre l'analyse morphologique retrouvait un
aspect global de trabéculation à l'apex persistant
au delà de l'insertion distale des piliers
valvulaires compatible avec une non compaction
isolée du ventricule gauche dans sa forme
mineure (fig.2).
Ailleurs il n'était pas noté d'anomalie de la
cinétique segmentaire, du rehaussement tardif ou
de thrombus intra cavitaire.
TABLEAU
Tableau 1 : Critères diagnostiques pour la NCIV du myocarde par Oechslin et coll.
1.
absence d'anomalies cardiques coexistantes (autre que 2
-
4 ci
-
dessous) par définition
2.
structure typique du myocarde à deux couches avec une bande (épicarde) mince extérieure compactée
et une couche (endocarde) intérieure non compactée beaucoup plus épaisse comprenant un réseau
trabéculaire avec des espaces endocardiques profonds (le rapport télésystolique maximal entre le
myocarde non-compacté et le myocarde compacté > 2 est caractéristique). Mesure du court axe
parasternal en télésystole.
3.
localisation segmentaire prédominante de l'anomalie dans la région apicale et moyenne de la paroi
inférieure et latérale.
4.
ligne à l'échographie doppler couleur de récessus intertrabéculaires profondément perfusés (sans
communication avec la circulation coronarienne)
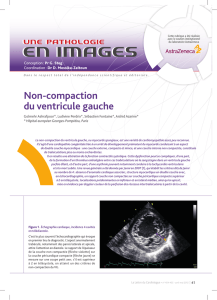
Fig.1 :
IRM cardiaque
: EG T2 dans les trois plans de référence
(petit axe VG (1), long axe VG (2) et 4 cavités (3)) retrouve cette
aspect de double couche myocardique, une interne non compactée
avec de multiples trabéculations (flèches droites) et une externe
compacte (flèche courbe).
Fig.1: Cardiac MRI: EG T2 weighed acquisitions in the short and
long axis of left ventricle and four chambers view depict multiple
prominent ventricular trabeculations of the inner layer (right arrow)
and a thin compacted outer band (curved arrow).
Fig 2 :
IRM cardiaque EG T2 dans le plan
des 4 cavités (1) et du petit axe du VG (2)
retrouve un aspect de double couche,
hypertrabéculation au niveau de l'apex et du
tiers moyen (flèches).
Figure 2: Cardiac MRI: EG T2 weighed
acquisitions in the 4 chambers view (1) and
in the short axis of the left ventricle (2):
prominent apical trabeculation (arrows).
A Dione DIOP et al
J Afr Imag Méd 2014; 6 (3):50-55

DISCUSSION
La non-compaction ventriculaire a été décrite
pour la première fois chez une femme âgée de 33
ans par Engberding et al. en 1984[2]. Elle a été
classée récemment comme une cardiomyopathie
génétique causée par une anomalie de
l’embryogenèse de l’endocarde et du myocarde
in utero[3], avec un myocarde en double couche,
une externe compactée et une interne composée
de trabéculations ventriculaires proéminentes
avec de profonds récessus inter-trabéculaires.
Les zones les plus fréquemment atteintes sont
l’apex du VG et les parois latérale et inférieure
du tiers moyen. Cela s’explique par le fait que
sur plan embryologique, la compaction se fait de
la base vers l’apex, de l’épicarde vers
l’endocarde et du septum vers la paroi libre du
VG.
Elle peut être isolée ou associée à diverses
anomalies cardiaques, telles qu’une obstruction
de la voie de chasse ventriculaire droite ou
gauche, une cardiopathie congénitale cyanotique
complexe et des anomalies coronariennes.
Cependant, par définition, la non compaction
isolée du ventricule gauche (NCVI) survient en
l’absence d’autres anomalies cardiaques
coexistantes [4].
Sur le plan génétique on distingue deux formes
[3] :
une familiale plus souvent diagnostiquée à
l’enfance en rapport avec une mutation du
gène G4.5 situé sur la région chromosomique
Xq28 et
une sporadique rencontrée chez l’adulte de
transmission autosomique dominante.
Les manifestations cliniques de cette maladie
sont assez diverses et le diagnostic est souvent
retardé en raison de la connaissance limitée de
ses caractéristiques d’imagerie et cliniques [5].
Ses circonstances de découverte sont
extrêmement variables allant d’un diagnostic
échocardiographique accidentel sans symptômes
à une insuffisance cardiaque incapacitante.
Souvent, les raisons de l’orientation vers un
cardiologue chez les patients qui recevront
finalement un diagnostic de NCVI incluent une
insuffisance cardiaque inexpliquée, certaines
observations échocardiographiques, des
palpitations ou un essoufflement à l’effort Les
trois tableaux cliniques les plus fréquents
incluent l’insuffisance cardiaque, les arythmies
et les événements emboliques [3]. D’autres
symptômes présentés incluent les douleurs
thoraciques et la syncope [6].
Traditionnellement, le diagnostic de NCVI est
fondé sur une échocardiographie en mode 2D et
est caractérisé par la présence de nombreuses
trabéculations proéminentes avec des récessus
profonds dans des segments hypertrophiés et
souvent hypokinétiques du VG. Les zones les
plus fréquemment atteintes sont l’apex du VG,
les parois latérale et inférieure du tiers moyen
(figure 2) [3].
Les critères échocardiographiques les plus
fréquemment utilisés pour le diagnostic de la
NCVI chez les adultes sont conformes à la
proposition d’Oechslin (tableau 1) [3].
Toutefois Kohli et al [7] ont montrés qu'il y
avait une trop grande sensibilité des critères
échographiques. En effet dans leur série 23,6%
des patients explorés par échocardiographie pour
altération systolique du VG avait un ou plusieurs
des critères échographiques de la NCVI.
Devant ces constations l’IRM s’est imposée
comme l’examen de référence dans le diagnostic
de la NCVI. Elle a non seulement un rôle
diagnostic mais également pronostic. Du fait de
sa plus grande résolution spatiale elle permet de
détecter les formes subtiles de NCVI comme
chez notre second patient. Elle évalue le
pronostic en fournissant des données sur la
fonction cardiaque, la perfusion myocardique, le
degré de fibrose myocardique, l’identification
des thrombi ventriculaires et recherche les
diagnostics alternatifs.
Les constatations à l’IRM dans le cas d’une
NCVI incluent :
A Dione DIOP et al
J Afr Imag Méd 2014; (6), 3: 50-55

De nombreuses trabéculations excessives
dans le ventricule gauche avec une
atteinte prédominante des segments
apicaux et moyen des parois latérale et
inférieure [3]
Un amincissement de la paroi du VG lors
de la diastole
La présence d’un myocarde structuré en
deux couches avec un rapport
myocardique en phase diastolique entre
la surface compactée et la surface non
compactée > 2,3 [8].
Toutefois le calcul de la masse ventriculaire
gauche trabéculée par la formule suivante reste
le meilleur critère diagnostic de la NCVI [9]:
[(Masse du ventriculaire gauche globale - la
masse ventriculaire gauche compacté) / la masse
ventriculaire gauche global]
A. Jacquier et al rapportent dans leur étude
comparative entre NCVI, cardiomyopathie
dilatée, cardiomyopathie hypertrophique et des
sujets témoins sains que le pourcentage de masse
trabéculée était trois fois plus élevé chez les
patients atteints de NCVI que chez les autres et
représentait 20% de la masse ventriculaire
gauche globale avec une sensibilité et une
spécificité de 93.7% [9].
Le pronostic de la NCVI est imprécis. Les
patients pourraient demeurer longtemps
asymptomatiques en évolution très progressive
sans complications emboliques ni arythmies
ventriculaires. Aras et al rapportent dans leur
étude réalisée chez des adultes que 43% de leurs
patients avaient présenté une baisse progressive
de la fraction d’éjection ventriculaire gauche au
cours d’une période de trois ans [6].
Le pronostic de NCVI est plus lié à la gravité de
la dysfonction systolique sous-jacente qui
favorise la formation de thrombi intra cavitaires,
qui associés aux troubles du rythme peuvent
occasionner des accidents thromboemboliques
majeurs intéressant les systèmes cérébro -
vasculaire, pulmonaire, vasculaire périphérique
ou mésentérique.
La prise en charge thérapeutique n’est pas
codifiée. Elle est tout d’abord symptomatique.
L’approche préventive est très discutée. L’intérêt
des anticoagulants s’avère nécessaire en cas de
haut risque d’accident thromboembolique.
L’implantation systématique d’un défibrillateur
devant le risque arythmique reste à évaluer. La
transplantation cardiaque, surtout chez le sujet
jeune, n’est pas une recommandation
communément admise. Toutefois, en cas d’échec
du traitement médical la mise en place de
pacemaker ou même une transplantation
cardiaque doit être considérée [3].
Enfin, les membres de la famille de premier
degré de tous les patients ayant reçu un
diagnostic de NCVI devraient subir un
échocardiogramme de dépistage.
CONCLUSION
La NCVI est un trouble congénital génétique
rare causé par la dysfonction du processus de
compaction embryogénique du myocarde
normal. Son tableau clinique est extrêmement
variable, allant du diagnostic
échocardiographique accidentel à l’insuffisance
cardiaque symptomatique, à la thrombo-embolie
et à l’arythmie. Les principales modalités
diagnostiques sont l’échocardiogramme 2D et
l’IRM, toutes deux ayant des critères
diagnostiques clairement définis. Le dépistage
des parents de premiers degrés est recommandé.
A Dione DIOP et al
J Afr Imag Méd 2014; 6 (3):50-55
 6
6
1
/
6
100%