Classe TS – TP Chimie – étude d`une réaction d`estérification ACIDE

Classe TS – TP Chimie – étude d'une réaction d'estérification
TP noté avec changement de binôme
ACIDE CARBOXYLIQUE + ALCOOL ⇄ ESTER + EAU
Cette importante réaction est équilibrée (c'est-à-dire en compétition avec la réaction inverse appelée hydrolyse), lente
(accélérée avec la température ou/et un catalyseur) , athermique (qui ne produit pas de chaleur par elle-même)
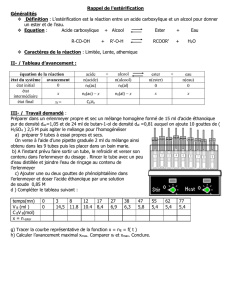
Réaliser le montage suivant appelé montage à reflux :
Dans un ballon mettre 6 g d'acide éthanoïque pur et 4,6 g d'éthanol
pur. Ajouter 5 gouttes d'acide sulfurique quasi pur (catalyseur).
Installer le réfrigérant à eau et porter l'ensemble à ébullition.
Compter une bonne vingtaine de minutes à reflux (dès que les
gouttes se condensent et retombent dans le ballon)
a) écrire l'équation de cette réaction en utilisant des formules semi-
développées sachant que l'ester s'appelle éthanoate d'éthyle.
b) faire un tableau d'avancement avec 4 lignes sous l'équation : pour t=0 , pour t quelconque , pour t ≈ 20 min (laisser
en blanc pour le moment) et en supposant que la réaction soit totale ce qui ne sera pas le cas. Quel est le réactif
limitant ? Quel est l'avancement maximum ?
Préparer une burette contenant de la soude 0,2 mol/L.
Doser une goutte d'acide sulfurique quasi-pur que vous aurez mise dans un peu d'eau distillée avec une goutte de BBT
c) écrire l'équation de la réaction de ce dosage. On respectera la règle suivante : pour les espèces acides ou basiques
fortes, on écrit les ions dans les équations. Pour les espèces acides ou basiques faibles, on écrit les molécules dans les
équations. La soude et l'acide sulfurique sont des espèces fortes. Le sel obtenu est soluble et totalement dissocié.
d) quel est le volume équivalent ? En déduire n(H+) contenu dans une goutte d'acide sulfurique quasi-pur.
Il est souhaitable d'effectuer 2 dosages successifs, d'utiliser toujours le même compte gouttes en effectuant les mêmes
gestes.
Au bout des 20 minutes de reflux, soulever le ballon pour laisser refroidir le ballon à l'air. Le refroidir avec de l'eau
puis mettre un volume de l'ordre de 50mL d'eau distillée froide dans le ballon avec le mélange réactionnel pour arrêter
la réaction puis transvaser le contenu du ballon dans une fiole de 100 mL. Compléter jusqu'au trait de jauge avec de
l'eau froide d'abord versée dans le ballon pour récupérer au mieux les eaux de rinçage. Observer l'ester qui surnage, le
sentir puis bien fermer la fiole et homogénéiser: l'ester doit se dissoudre.
Préparer une burette contenant de la soude 0,2 mol/L.
Doser 10 mL du contenu de la fiole jaugée en présence de phénol phtaléine. Il est souhaitable d'effectuer 2 dosages.
Dans ce dosage, la soude attaque l'acide sulfurique qui n'a pas été consommé, car il joue le rôle de catalyseur, et l'acide
éthanoïque restant .
e) écrire l'équation de la réaction de la soude avec l'acide éthanoïque sachant que l'acide éthanoïque est un acide faible.
Le sel obtenu est soluble et totalement dissocié.
f) quel est le volume équivalent de ce dosage ? Quelle est la part de ce volume revenant au dosage de l'acide
sulfurique ? En déduire la part revenant à l'acide éthanoïque. En déduire enfin la quantité de matière d'acide éthanoïque
restant dans le mélange après environ 20 min de reflux. Compléter maintenant la ligne laissée vide dans le tableau
d'avancement.
g) Quel est l'avancement de la réaction au bout de 20 min ?
h) Quel est le taux d'avancement de la réaction au bout de 20 min, τ = x20min/xmax si la réaction était totale ?
Ce taux d'avancement est de 67% (ou 2/3) d'après les livres si la réaction n'évolue plus. Qu'en déduit-on quant à
l'évolution de la réaction que vous avez réalisée ?
i) On définit le quotient de la réaction ainsi : Q = [ester].[eau]/([acide carboxylique].[alcool]).
Calculer Q à l'instant t = 0 , Q de votre réaction à t environ 20 min , et Q si la réaction avait été totale.
j) On appelle K la constante de la réaction à l'équilibre, c'est-à-dire lorsque la réaction n'évolue plus. C'est la valeur de
Q à l'équilibre. Quelle est la valeur théorique de K sachant que d'après les livres, dans les conditions de l'expérience, le
taux d'avancement est de 67% (ou 2/3) ?
k) Questions pour un champion. Sachant que K est une valeur caractéristique de cette réaction, trouver la valeur du
taux d'avancement si les conditions initiales étaient les suivantes : 12 g d'acide éthanoïque et 4,6 g d'éthanol.
Trouver 2 raisons pour lesquelles dans l'industrie on a intérêt à travailler avec un grand excès du réactif le moins cher
quand une réaction est lente et équilibrée ?
l) écrire l'équation de la réaction entre l'acide méthanoïque et le butan-2-ol en utilisant des formules semi-développées
et en nommant l'ester formé.
Eau
froide
Chauffe ballon
Réfrigérant à
eau
1
/
1
100%